
| A. | N2 | B. | Na2O2 | C. | NaCl | D. | H2O2 |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①⑥ | B. | ①②③④⑥ | C. | ①②③⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
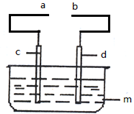 某小组为研究电化学原理,设计如图所示装置:
某小组为研究电化学原理,设计如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- | |
| B. | 能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- | |
| C. | 使酚酞变红的溶液:Ba2+、Na+、Cl-、NO3- | |
| D. | 能溶解Al(OH)3固体的溶液:K+、Na+、HCO3--、NO3-- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁与稀盐酸反应 | B. | CO燃烧生成CO2 | ||
| C. | 氢氧化钡晶体与氯化铵晶体反应 | D. | 生石灰溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
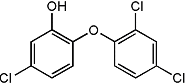 三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )
三氯生化学名为2,4,4-三氯-2羟基-二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中不正确的是( )| A. | 物质的分子式为C12H7Cl3O2 | |
| B. | 该物质苯环上的一溴取代物有6种 | |
| C. | 该物质中含有四种官能团 | |
| D. | 该物质中所有原子都可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | N2→NO→NO2→HNO3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | S→SO3→H2SO4→MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
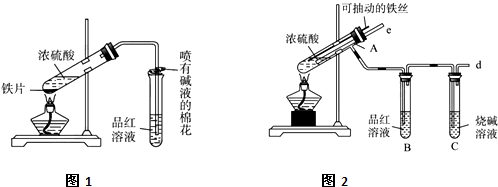
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com