
【题目】为探究氧化铜与硫的反应并分析反应后的固体产物,设计如下实验装置。
(1)如图连接实验装置,并_____。
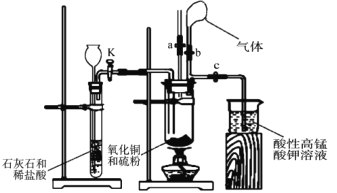
(2)将氧化铜粉末与硫粉按 5:1 质量比混合均匀。
(3)取适量氧化铜与硫粉的混合物装入大试管中,固定在铁架台上,打开_____ 和止水夹 a 并______,向长颈漏斗中加入稀盐酸,一段时间后,将燃着的木条放在止水夹 a 的上端导管口处,观察到木条熄灭,关闭活塞 K 和止水夹 a,打开止水夹 b。该实验步骤的作用是______,石灰石与稀盐酸反应的离子方程式为___________________。
(4)点燃酒精灯,预热大试管,然后对准大试管底部集中加热,一段时间后,气球膨胀, 移除酒精灯,反应继续进行。待反应结束,发现气球没有变小,打开止水夹 c,观察到酸性高锰酸钾溶液褪色后,立即用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞 K。这样操作的目的是__________________。
(5)拆下装置,发现黑色粉末混有砖红色粉末。取少量固体产物投入足量氨水中,得到无色溶液、但仍有红黑色固体未溶解,且该无色溶液在空气中逐渐变为蓝色。查阅资料得知溶液颜色变化是因为发生了以下反应:4[Cu(NH3)2]+ + O2+8NH3 H2O=4[Cu(NH3)4]2++4OH-+6H2O。
①经分析,固体产物中含有Cu2O。Cu2O 溶于氨水反应的离子方程式为______。
②仍有红色固体未溶解,表明氧化铜与硫除发生反应 4CuO + S![]() 2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
2Cu2O+SO2外,还一定发生了其他反应,其化学方程式为_________。
③进一步分析发现 CuO 已完全反应,不溶于氨水的黑色固体可能是_____(填化学式)。
【答案】检查装置气密性 活塞K 关闭 b、c 排除装置中的空气或氧气 CaCO3 +2H+ =Ca2++ H2O+CO2↑ 避免SO2污染空气 Cu2O+4NH3 · H2O =2[Cu(NH3)2]++2OH-+3H2O 2CuO+S![]() 2Cu+SO2 Cu2S
2Cu+SO2 Cu2S
【解析】
(1)硫在加热条件下易于空气中的氧气反应,对该实验会产生影响,要确保实验装置中无空气,保证密闭环境;
(3)氧化铜与硫的反应,需在无氧条件下进行,石灰石与盐酸反应产生的CO2气体排除装置中的空气;
(4)酸性高锰酸钾溶液褪色,说明产物有SO2,二氧化硫有毒不能排放到大气中;
(5)反应剩余固体含有Cu2O(砖红色),加入氨水后但仍有红黑色固体未溶解,表明有Cu,CuO与S的质量比为5∶1。而生成Cu2O的反应方程式为4CuO+ S![]() 2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量。
2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量。
(1)探究氧化铜与硫的反应,需在无氧条件下进行(S在空气与O2反应),故需对装置进行气密性检查;
(3)利用石灰石与盐酸反应产生的CO2气体排除装置中的空气,打开K使盐酸与石灰石接触,打开a,并检验是否排尽空气,该实验步骤的作用是排除装置中的空气或氧气。石灰石与盐酸反应的离子方程式是CaCO3+2H+=Ca2++ H2O+CO2↑;
(4)酸性高锰酸钾溶液褪色,说明产物有SO2,用盛有氢氧化钠溶液的烧杯替换盛装酸性高锰酸钾溶液的烧杯,并打开活塞K的目的是尽量使SO2被吸收,避免污染环境;
(5)结合题意,反应剩余固体含有Cu2O(砖红色),因为Cu2O与氨水反应为Cu2O+4NH3·H2O=2[Cu(NH3)2]+(无色)+2OH-+ 3H2O,4[Cu(NH3)2]++O2+8NH3·H2O=4 [Cu(NH3)4]2+(蓝色)+4OH-+6H2O。但仍有红黑色固体未溶解,表明有Cu,反应方程式为2CuO+S![]() 2Cu+SO2,其中CuO与S的质量比为5∶1。而生成Cu2O的反应方程式为4CuO+ S
2Cu+SO2,其中CuO与S的质量比为5∶1。而生成Cu2O的反应方程式为4CuO+ S![]() 2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量,则可能发生反应2Cu+S
2Cu2O+SO2,其中CuO与S的质量比为10∶1,因此S过量,则可能发生反应2Cu+S![]() Cu2S,黑色固体为Cu2S。
Cu2S,黑色固体为Cu2S。


科目:高中化学 来源: 题型:
【题目】T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C变化如图所示。
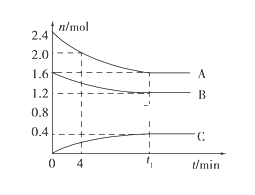
(1)写出该反应的化学方程式:___________;
(2)该温度下该反应的平衡常数为(保留两位有效数字)_______;
(3)已知:K(300℃)>K(350℃),该反应是________热反应;
(4)0~4分钟时,A的平均反应速率为____________;
(5)到达平衡时B的转化率为____________;
(6)恒容条件下,下列措施中能使![]() 降低的有__________。
降低的有__________。
A 充入氦气 B 使用催化剂
C 再充入2.4mol A和1.6mol B D 降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是
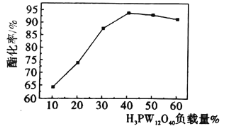
A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,硫酸盐 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(约 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀现白色浑浊,而滴入 1 滴(约 0. 05 mL) 0. 01 mol/L SrCl2 溶液无浑浊出现。下列说法中错误的是
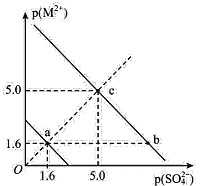
A.该温度下,溶度积常数 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c点对应BaSO4溶液移向b点,可加浓BaCl2溶液
C.欲使c点对应SrSO4溶液移向a点,可加浓SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常数为106.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,达到化学平衡状态,下列说法正确的是( )
2NH3(g)ΔH<0,达到化学平衡状态,下列说法正确的是( )
A.其他条件不变时,增大c(N2),H2的平衡转化率增大
B.其他条件不变时,降低温度,n(NH3)减小
C.其他条件不变时,增大压强,该反应的平衡常数增大
D.其他条件不变时,升高温度,该反应的化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国规定,所有销售的食品包装标签配料表上食品添加剂应使用规定的产品名称或种类名称,其中甜味剂、防腐剂、着色剂应注明。右图标签注明的添加剂中属于着色剂的是
①柠檬酸 ②山梨酸钾 ③甜味素
④菠萝香精 ⑤柠檬黄 ⑥日落黄

A.①②⑤B.②⑤⑥C.⑤⑥D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是

A. 一定含有Al,其质量为4.05g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2 和FeCl2
D. 一定含有(NH4)2SO4 和MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是地壳中含量最高的金属元素,其单质及其化合物在生产生活中的应用十分广泛。
(1)铝原子最外层电子排布式是________,铝原子核外有___种能量不同的电子。
(2)1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。不用钾与氯化铝溶液制铝的理由是_________;现代工业炼铝是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为___________________________。
(3)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
3Ba↑+BaO·Al2O3,用化学平衡移动原理解释上述方法可制取金属Ba的原因是________。
(4)LiAlH4由Li+、A1H4-构成,是有机合成中常用的试剂,LiAlH4在125℃分解为LiH、H2和Al。
①比较Li+、 H-、Al3+、H+离子半径大小____________。
②写出LiAlH4分解的方程式(需配平)_______,若反应生成3.36 L氢气(标准状况下),则有____g铝生成。
③LiAlH4与乙醛反应可生成乙醇,推断LiAlH4是反应的_________剂。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬是一种氧气吸收剂, 通常以二水盐[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,难溶于冷水,易溶于盐酸。其制备原理和实验装置:
制备原理:![]()
实验装置:(如图所示)
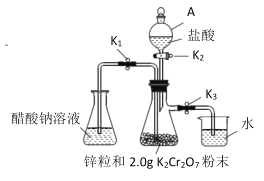
(1)仪器 A 的名称是__________。
(2)装好试剂后按上述装置进行实验,完成下表内容。
操作步骤 | 实验现象 | 发生反应的离子方程式 |
关闭①___________________,打开②_______________,(用K1、K2、K3填写,下同)使盐酸缓慢加入至抽滤瓶中 | 抽滤瓶中锌粒溶解,溶液由橙色逐渐变成蓝色,有少量气泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽滤瓶中产生大量气体时快速加入适量盐酸,关闭K2和④__________________,打开⑤_________ | 抽滤瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
当溶液完全转移后,迅速塞紧锥形瓶,用冷水冷却 | 锥形瓶中有深红色晶体析出 | ⑦_____________ |
(3)洗涤产品后干燥、称量,得到 1.0g 固体。列式表示产率:____(不必计算出结果,K2Cr2O7 式量:294)。在实验中如果盐酸过量,会导致产率偏________。(填“高”或“低”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com