
| A酸雨的形成 | B治疗胃酸过多 | C切开的苹果发霉 | D.放鞭炮 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 反应中存在元素的化合价变化为氧化还原反应,若不存在元素的化合价变化,则不属于氧化还原反应,以此来解答.
解答 解:A.酸雨在形成过程中,亚硫酸被空气中的氧气氧化,S、O元素的化合价发生变化,属于氧化还原反应,故A错误;
B.治疗胃酸过多,是氢氧化铝与盐酸发生中和反应,非氧化还原反应,故B正确;
C.切开的苹果发霉是苹果被空气中的氧气氧化而变质,故C错误;
D.燃放烟花爆竹时,C、S等元素化合价发生变化,所以属于氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应,侧重于化学与生活、生产的考查,把握发生的化学反应及反应中元素的化合价变化为解答的关键,注意从化合价角度分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | 常温下pH=6的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
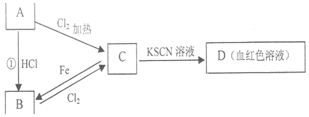 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
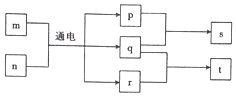 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期.m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001mol•L-1s溶液的pH为3,t是混合溶液,且该溶液具有漂白性.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期.m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001mol•L-1s溶液的pH为3,t是混合溶液,且该溶液具有漂白性.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 元素Y分别与W、X、Z形成的化合物中一定含有离子键 | |
| B. | 离子半径:X<Y<Z | |
| C. | 由元素W、X组成的化合物中一定只含极性键 | |
| D. | s为强酸,r为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
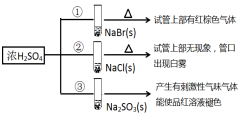
| A. | 对比①和②可以说明还原性Br->Cl- | |
| B. | ①和③相比可说明氧化性Br2>SO2 | |
| C. | ②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl | |
| D. | ③中浓H2SO4被还原成SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z | |
| B. | 单质熔点:W>X | |
| C. | X、Y的氧化物均能与Z的氧化物对应的水化物反应 | |
| D. | X、W的最简单氢化物的水溶液均显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液是钠盐溶液 |
| B | 向Fe(NO3)2溶液中滴加稀硫酸,再滴加几滴KSCN溶液 | 溶液变红色 | 稀硫酸能氧化Fe(NO3)2 |
| C | 向AgCl悬浊液加入NaI溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| D | 向KI溶液中加入新制氯水和CCl4,C充分振荡、静置 | 液体分层,下层紫红色 | Cl2的氧化性强于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com