
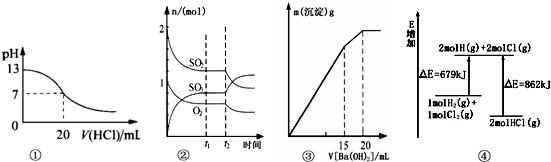
| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 | |
| B. | 图②表示一定条件下进行的反应2SO2(g)+O2(g)?2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 | |
| C. | 图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 | |
| D. | 图④表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
分析 A.酸碱中和在接近终点时,pH会发生突变,曲线的斜率应该很大,图象曲线变化与实际不相符;
B.根据图②曲线变化可知,t2时刻后二氧化硫和氧气的物质的量减小,而三氧化硫的物质的量增大,说明平衡正向移动,结合反应为气体体积缩小的反应及平衡移动原理分析;
C.向明矾溶液中加入Ba(OH)2溶液,开始阶段生成硫酸钡和氢氧化铝沉淀,随后继续生成硫酸钡沉淀,而氢氧化铝沉淀溶解,最后沉淀完全为硫酸钡,沉淀质量达到最大时氢氧化铝完全溶解;
D.反应H2(g)+C12(g)═2HCl(g)为放热反应,该反应的反应热△H应该为负值.
解答 解:A.0.1mol•L-1NaOH溶液的pH为13,用0.1mol•L-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,图象曲线变化与实际不相符,故A错误;
B.根据图②分析,t2时刻后二氧化硫和氧气的物质的量减小,而三氧化硫的物质的量增大,说明平衡正向移动,结合反应的特点及平衡移动原理分析,t2时刻改变的条件可能是降低温度或缩小容器体积,故B正确;
C.向明矾溶液中加入Ba(OH)2溶液,开始阶段生成硫酸钡和氢氧化铝沉淀,随后形成硫酸钡沉淀,而氢氧化铝沉淀溶解,最后沉淀为硫酸钡,由图象可知,在加入20 mL Ba(OH)2溶液时铝离子恰好转化为偏铝酸根,故C错误;
D.根据图④分析,反应H2(g)+C12(g)═2HCl(g)为放热反应,则该反应的反应热△H=-183 kJ/mol,故D错误;
故选B.
点评 本题考查较为综合,涉及中和滴定、热化学方程式书写、化学平衡及其影响、离子反应的应用等知识,题目难度中等,注意掌握反应热与焓变的关系,C为易错点,明确发生反应原理为解答关键,试题培养了学生的分析能力及灵活应用能力.


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH
(1)写出工业上分别以①CH2=CH2为原料和②C6H12O6为原料制取乙醇的化学方程式:①CH2=CH2+H2O$→_{高温高压}^{催化剂}$CH3CH2OH②C6H12O6$\stackrel{催化剂}{→}$2CO2↑+2CH3CH2OH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,还原剂一定是失去电子的反应物 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 某元素从化合态转变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 类别 | 物质 |
| A | 碱性氧化物 | Na2O2 CuO MgO |
| B | 难溶性物质 | Ba(OH)2 MgSO4 Na2SiO3 |
| C | 弱酸 | H2S H2SO4 CH3COOH |
| D | 强电解质 | AgCl MgSO4 CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | 电离平衡常数(25℃) |
| HClO | K=2.98×10-8 |
| H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
| H2SO3 | K1=1.54×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
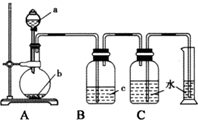 如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )
如图是制取、净化并测量生成气体体积的装置示意图.利用如图装置进行表所列实验,能达到实验目的是 ( )| 选项 | a(液体) | b(固体) | c(液体) |
| A | 稀盐酸 | 锌粒 | 浓硫酸 |
| B | 浓氨水 | 生石灰 | 浓硫酸 |
| C | 饱和食盐水 | 电石 | 硫酸铜溶液 |
| D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com