
分析 H2A在水中的电离方程式:H2A═H++HA-;HA-?H++A2-,其第一步完全电离,第二部电离可逆,HA-只电离不水解,
(1)强碱弱酸盐中阴离子水解导致溶液显示碱性,根据水解方程式的书写方法来回答;
(2)根据溶液中的电荷守恒、物料守恒以及质子守恒来回答;
(3)0.1mol•L-1H2A溶液,H2A?H++HA-,电离出H+小于0.1mol/L,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离.
解答 解:(1)根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是:H2O+A2-?HA-+OH-,
故答案为:碱性;H2O+A2-?HA-+OH-;
(2)0.1mol•L-1的Na2A溶液中,A2-能够水解生成HA-,HA-不水解,
A、根据物料守恒,c(A2-)+c(HA-)=0.1mol/L,故A错误;
B、根据质子守恒:c(OH-)=c(H+)+c( HA-),故B错误;
C、0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D、在0.1mol•L-1的Na2A溶液中离子浓度大小,c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+),故D错误.
故答案为:C;
(3)因为0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+;而0.1mol•L-1H2A溶液,H2A=H++HA-,电离出H+0.1mol/L和HA-0.1mol/L,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;H2A第一步电离产生的H+,抑制了HA-的电离,而NaHA中不存在抑制作用.
点评 本题考查学生盐的水解规律以及离子浓度之间的守恒关系等方面的知识,注意所学知识的灵活应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
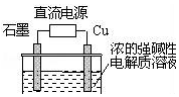 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法正确的是( )
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法正确的是( )| A. | 石墨电极上产生氧气 | |
| B. | 铜电极发生还原反应 | |
| C. | 铜电极接直流电源的正极 | |
| D. | 当有0.1mol电子转移时,有0.1molCu2O生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸 | B. | 乙醇 | ||
| C. | 少量硝酸和硝酸银混合溶液 | D. | 盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ②④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热,然后将气体生成物通入澄清石灰水,观察现象 | |
| B. | 向两种相同浓度的盐溶液中滴入稀盐酸,观察反应的剧烈程度 | |
| C. | 向两种相同浓度的盐溶液中滴入酚酞,观察颜色 | |
| D. | 向两种相同浓度的盐溶液中滴入氢氧化钡溶液,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠和冷水反应 Na+2H2O═Na++H2↑+OH- | |
| D. | 铜片与稀硝酸反应 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com