
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)

A. 当M为盐酸、杠杆为导体时,A端高,B端低
B. 当M为AgNO3、杠杆为导体时,A端高,B端低
C. 当M为CuSO4、杠杆为导体时,A端低,B端高
D. 当M为CuSO4、杠杆为绝缘体时,A端低,B端高
【答案】C
【解析】
A. 当M为盐酸、杠杆为导体时,向烧杯中央滴入盐酸溶液,构成Fe、Cu原电池,Fe为负极,发生Fe-2e-═Fe2+,Cu为正极,发生2H++2e-═H2↑,则A端低,B端高,故A错误;B. 当M为AgNO3、杠杆为导体时,向烧杯中央滴入AgNO3溶液,构成Fe、Cu原电池,Fe为负极,发生Fe-2e-═Fe2+,Cu为正极,发生2Ag++2e-═2Ag,则A端低,B端高,故B错误;C. 当M为CuSO4、杠杆为导体时,向烧杯中央滴入浓CuSO4溶液,构成Fe、Cu原电池,Fe为负极,发生Fe-2e-═Fe2+,Cu为正极,发生Cu2++2e-═Cu,则A端低,B端高,故C正确;D. 当M为CuSO4、杠杆为绝缘体时,杠杆为绝缘体时,只发生Fe与硫酸铜溶液的反应,在Fe的表面附着Cu,质量变大,则A端高,B端低,故D错误;故选C。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成红黄色的易爆物二氧化氯。
(1)请完成该过程的化学方程式并配平。
____KClO3+___HCl(浓)===____KCl+____ClO2↑+____Cl2↑+___(_________)
(2)浓盐酸在反应中显示出来的性质是__(填写编号)。
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1molCl2,则转移的电子数为__。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)1kgClO2相当于___kgCl2。(提示:Cl2和ClO2在消毒过程中均变为Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D、E、F、G、H均为有机化合物。

回答下列问题:
(1)有机化合物A的相对分子质量小于60,A能发生银镜反应,1 mol A在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是__________________,由A生成B的反应类型是__________;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C 生成D的化学方程式是_________________________________________________;
(3)①芳香族化合物E的分子式是C8H8Cl2 ,E的苯环上的一溴取代物只有一种,则E的所有可能的同分异构体共有________种;
②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4)。1 mol G与足量的NaHCO3溶液反应可放出44.8 L CO2(标准状况),由此确定E的结构简式是_____________________________________;
(4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是________________________________________________________该反应的反应类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值。请回答下列问题:
(1)0.5mol SO2共含有约_______个原子,它与_______g SO3所含硫原子数相等。
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号)___________。
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是

A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②为工业上制备漂白粉的反应原理
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、X是中学化学中常见的四种物质,且a、b、c中含有同一种元素,其转化关系如下图所示。下列说法不正确的是
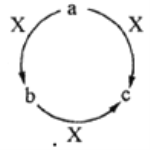
A. 若a、b、c均为厨房中常用的物质,则构成c中的阳离子半径小于其阴离子半径
B. 若a为一种气态氢化物,X为O2,则a分子中可能含有10个或者18个电子
C. 若b为一种两性氢氧化物,则X可能是强酸,也可能是强碱
D. 若a为固态非金属单质,X为O2,则O元素与a元素的原子序数之差可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A. 电极B上发生的电极反应为:O2+2CO2+4e-===2CO32-
B. 电极A上H2参与的电极反应为:H2+2OH--2e-===2H2O
C. 电池工作时,![]() 向电极A移动,电子由A极经电解质流向B极
向电极A移动,电子由A极经电解质流向B极
D. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4转移12 mol电子
3H2+CO,每消耗1 mol CH4转移12 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中含Ca2+、Mg2+、Fe3+、SO42—等杂质,需要提纯后才能综合利用。为除去粗盐中的杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)提纯的步骤有:①加入过量的Na2CO3溶液②加入过量的BaCl2溶液③加入过量的NaOH溶液④调节溶液的pH等于7⑤溶解⑥过滤⑦蒸发,正确的操作顺序是________(填选项字母)。
a.⑤②③①⑥④⑦ b.⑤①②③⑥④⑦ c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(2)操作Z的名称是_____,蒸发操作用到的仪器有酒精灯,玻璃棒,三脚架,泥三角还有 ________。
(3)第Ⅱ步中,写出除去Ca2+和Fe3+相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2,Fe3+的主要存在形式为FeCl3)____________________、____________________。
(4)判断SO42—已沉淀完全的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄,这种测量方法叫“铝铍测年法”。完成下列填空:
(1)写出Be的核外电子排布式___________。Be所在的周期中,最外层有2个未成对电子的元素的符号有_____、_______。
(2)Al和Be具有相似的化学性质,铝原子核外有 _____ 种不同运动状态的电子。写出BeCl2水解反应的化学方程式_______________________。
(3)研究表明26Al可以衰变为26Mg,请从原子结构角度解释这两种元素金属性强弱关系_______________。
(4)比较Al3+、S2-和C1-半径由大到小的顺序____________________;这3种元素最高价氧化物对应的水化物中酸性最强的是___________(写名称)。 Al2O3是离子化合物,而 AlCl3是共价化合物。工业制铝时,电解Al2O3而不电解AlCl3的原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com