
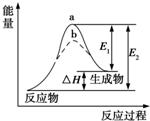
| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
分析 A.根据图象分析可知反应物能量低于生成物能量,为吸热反应;
B.加入催化剂会降低反应的活化能,加快反应速率,不改变化学平衡,反应焓变和起始终了物质能量有关和变化过程无关;
C.加入催化剂不会改变化学反应平衡;
D.催化剂能降低反应的活化能,从而加快化学反应速率.
解答 解:A.焓变△H=E2-E1,反应为吸热反应,故A错误;
B.催化剂会降低反应的活化能,不改变化学平衡,反应焓变△H不变,故B错误;
C.加入催化剂不会改变化学反应的平衡,化学平衡常数不变,故C错误.
D.催化剂能降低反应的活化能,b使用了催化剂从而加快化学反应速率,故D正确;
故选D.
点评 本题考查了反应能量变化的分析判断,图象分析是解题关键,反应的能量守恒是判断的依据,注意加入催化剂不会改变化学平衡,会降低反应的活化能,题目较简单.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
| A. | 由分子构成的物质中一定含有共价键 | |
| B. | 形成共价键的元素不一定是非金属元素 | |
| C. | 正四面体结构的分子中的键角一定是109°28′ | |
| D. | ClO2-的空间构型为直线型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.37 | B. | 0.24 | C. | 0.16 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| C. | PM2.5主要来自于煤和石油等化石燃料的燃烧 | |
| D. | 汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的△H>O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
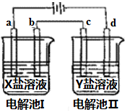 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | AgNO3 | KNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | CuSO4 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇能发生消去反应,而乙烷不能发生消去反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生硝化反应 | |
| D. | 乙烷在光照条件下能发生取代反应,而乙炔不能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:填空题
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量____________(填“>”“<”或“=”)890.3 kJ。
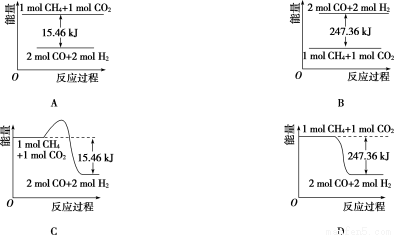
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①能表示该反应过程中能量变化的是____________(填字母)。
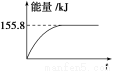
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为____________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热ΔH=____________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是_______________(填字母)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(C O、H2)
O、H2)
D.将固态碳合成为C60,以C60作为燃料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com