
下列对实验现象的预测不正确的是
A.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊
B.向Na2CO3饱和溶液中通入CO2,溶液变浑浊,继续通入CO2,有晶体析出
C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失
科目:高中化学 来源:2015-2016学年吉林长春第十一高中高二下期末考试化学卷(解析版) 题型:选择题
在80 g密度为d g/cm3的硫酸铁溶液中,含有2.8 g Fe3+离子,则此溶液中SO42-的物质的量浓度为(单位为mol·L-1)( )
A.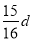 B.
B.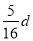 C.
C.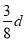 D.
D.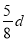
查看答案和解析>>
科目:高中化学 来源:2017届湖北襄阳市高三七月第二周周考理综化学(解析版) 题型:实验题
(14分)某种废锂电池正极材料的主要成分是LiCoO2,含少量Al、Fe等,LiCoO2不溶于水。实验室回收废锂电池制备锂单质的流程如图所示:

(1)正极材料酸浸时发生主要反应的化学方程式为_______。某同学从环境保护的角度考虑上述做法不合理,理由是_______,于是提出可用酸化的双氧水代替盐酸,则反应的离子方程式为______。
(2)Li2CO3在高温焙烧时发生反应的化学方程式为______。
(3)固体C与焦炭的反应需在真空条件下进行的原因是_______。
(4)工业上采用熔融盐电解法制备金属锂,电解质为熔融的LiCl-KCl,采用石墨阳极和低碳钢阴极,则阴极的电极反应式为______。如果用LiCl的水溶液代替熔融的LiCl-KCl,则其后果是_____。
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第VA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A. ①③ B. ④⑤ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
下列解释实验过程或事实的反应方程式不正确的是
A. 熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH =2NaAlO2+H2O
B. 刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+
C. 打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g) Mg(OH)2+H2↑
Mg(OH)2+H2↑
D. 向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I-+H2O2+2H+=I2+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省高三上学期开学考试化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数值。下列有关叙述正确的是
A.1mol Fe溶于过量硝酸,电子转移数为2NA
B.1mol N2与4mol H2反应生成的NH3分子数为2NA
C.标准状况下,2.24L CCl4含有的共价键数为0.4NA
D.14g乙烯和丙烯混合气体中的氢原子数为2NA
查看答案和解析>>
科目:高中化学 来源:2017届河北武邑中学高三上学期周考(8.21)化学试卷(解析版) 题型:填空题
(1)向Fe(OH)3胶体中加入饱和(NH4)2SO4溶液,发生的现象是_______, 原因_________。
(2)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化。
①先出现红褐色沉淀,原因是__________________;
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是__________________;
③最后溶液颜色加深,原因是______________;此反应的离子方程式是_____________;
(3)若用稀盐酸代替HI稀溶液,能出现(2)所述变化现象中的_____(填写上面各题序号)。
查看答案和解析>>
科目:高中化学 来源:2017届河北武邑中学高三上学期周考(8.14)化学试卷(解析版) 题型:填空题
(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
6SO2+Fe3O4,氧化产物为___________,若有3mol FeS2参加反应,转移_____mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为:___________(用离子方程式表示)。
③FeC13与氢碘酸反应时可生成棕色物质,该反应的离子方程式为_________________。
(2)己知:S2O32-具有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为:
S2O82-+2I-=2SO42-+I2 ① I2+2S2O32-=2I-+S4O62- ②
S2O82-、S4O62-、I2氧化性强弱顺序_______。
(3)己知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。

①a点处的还原产物是:________(填离子符号);
b点→c点反应的离子方程式是________。
②当溶液中的I-为0.5mol时、加入的KIO3可能是_________mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南长沙市新高一分班考试化学(解析版) 题型:选择题
碳化硅(SiC)陶瓷基复合材料是一种新型热结构材料。在空气中,碳化硅能与熔融的氢氧化钠发生反应:SiC+2NaOH+2O2=Na2SiO3+X+H2O,下列有关X物质的化学式推断中,正确的是( )
A.SiO2 B.CO C.CO2 D.Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com