在某温度下,将H2和I2各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定C(I2)的变化,5S时测定C(I2)=0.0080mol/L并保持不变. H2+I2(g)?2HI(g)
(1)反应的平衡常数的表达式是K=______;
(2)此温度下,平衡常数值为______;
(3)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为______.
【答案】
分析:(1)依据平衡醋酸概念写出表达式;
(2)计算平衡状态下,物质的平衡浓度,结合平衡常数概念计算;
(3)温度不变,平衡常数不变,依据化学平衡三段式列式计算.
解答:解:(1)依据化学反应 H
2(g)+I
2(g)?2HI(g),结合平衡醋酸的概念是用平衡状态生成物浓度的幂次方乘积除以反应物浓度的幂次方乘积,
则K=

,故答案为:
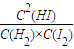
;
(2)依据化学平衡的三段式列式,用平衡状态下物质浓度计算;5S时测定C(I
2)=0.0080mol/L并保持不变说明达到平衡,碘单质物质的量为0.08mol;反应变化的物质的量为
H
2(g)+I
2(g)?2HI(g),
起始量(mol) 0.1 0.1 0
变化量(mol) 0.02 0.02 0.04
平衡量(mol) 0.08 0.08 0.04
平衡浓度C(H
2)=.08mol/L;C(I
2)=0.8mol/L;C(HI)0.4mol/L
平衡常数K=
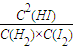
=
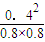
=0.25,故答案为:0.25;
(3)若在此温度下,在10L的密闭器充入0.2molHI气体,平衡后平衡常数不变,设HI的变化物质的量为x;
2HI(g),?H
2(g)+I
2(g)
起始量(mol) 0.2 0 0
变化量(mol) x 0.5x 0.5x
平衡量(mol) 0.2-x 0.5x 0.5x
平衡浓度为:C(HI)=0.02-0.1x;C(H
2)0.05x;C(I
2)=0.5x
依据平衡常数概念计算:K=

=

=0.25;
x=0.16
转化率=

×100%=80%,
故答案为:80%.
点评:本题考查了化学平衡的计算应用,平衡醋酸的分析判断,转化率计算,题目难度中等.

 ,故答案为:
,故答案为: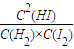 ;
;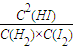 =
=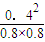 =0.25,故答案为:0.25;
=0.25,故答案为:0.25;  =
= =0.25;
=0.25; ×100%=80%,
×100%=80%,

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案