
粗铜精炼后的阳极泥含有Cu、Au(金)和PbSO4等杂质,湿法处理阳极泥进行综合利用的流程如下:
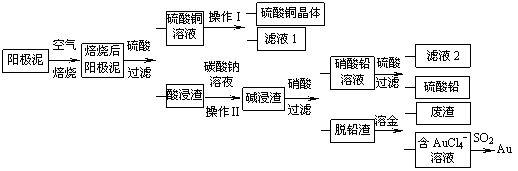

(1)用CuSO4做电解液电解含铜、金、铅的粗铜,阳极的电极反应式有: 和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是 ,焙烧后的阳极泥中除含金、PbSO4外,还有 (填化学式)。
(3)操作I的主要步骤为 ,操作Ⅱ的名称是 。
(4)写出用SO2还原AuCl4-的离子方程式 。
(5)为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,请指出流程图中另一处类似的做法 。
(6)已知298K时,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)= 1.82×10-8,用离子方程式表示加入碳酸钠溶液的作用 。
【知识点】电解原理、离子方程式的书写、物质分离和提纯的方法和基本操作综合应用
【答案解析】
(1) Pb+SO42--2e-= PbSO4 (2)将阳极泥粉碎,逆流焙烧等;CuO
(3)蒸发浓缩、降温结晶、过滤、洗涤、干燥;过滤
(4)2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+ (5)滤液2可以用来溶解碱浸渣,或并入硝酸中; (6)PbSO4(s)+CO32-(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
解析:(1)用CuSO4做电解液电解含铜、金、铅的粗铜,粗铜做阳极,电极材料放电,根据金属活动性顺序表,电极反应式为:Pb+SO42--2e-= PbSO4和Cu-2e-= Cu2+。
(2)焙烧阳极泥时,为了提高焙烧效率,采取的合理措施是将阳极泥粉碎,逆流焙烧等,焙烧后的阳极泥中除含金、PbSO4外,还有铜的产物CuO。
(3)操作I是由硫酸铜溶液得到硫酸铜晶体,主要步骤为蒸发浓缩、降温结晶、过滤、洗涤干燥;操作Ⅱ的名称是过滤;
(4)SO2做还原剂,化合价升高,对应产物为SO42-,AuCl4-化合价由+3价降为0价,根据得失电子守恒配平方程式:2AuCl4-+3SO2+6H2O=2Au+3SO42-+8Cl-+12H+
(5) 为了减少废液排放、充分利用有用资源,工业上将滤液1并入硫酸铜溶液进行循环操作,滤液2中含有大量硝酸,可以用来溶解碱浸渣,或并入硝酸中;
(6)沉淀的转化,由数据知,碳酸铅更难溶,离子方程式为:
PbSO4(s)+CO32-(aq) PbCO3(s)+SO42-(aq)
PbCO3(s)+SO42-(aq)
【思路点拨】本题考查了电解原理,涉及了电解精炼铜、化学实验基本操作、氧化还原反应的书写、沉淀的转化的综合知识,考查角度广,中等。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50mg,则
A.被氧化的砒霜为1.98mg
B.分解产生的氢气为0.672ml
C.和砒霜反应的锌为3.90mg
D.转移的电子总数为6×10—5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列各烃的分子式。
(1)烷烃B的分子中含有200个氢原子________。
(2)1 L烷烃D的蒸气完全燃烧时,生成同温同压下15 L的水蒸气________。
(3)已知在标准状况下,某气态烃的密度为1.34 g·L-1。将0.1 mol该气态有机物充分燃烧生成8.8 g CO2和5.4 g H2O________。
查看答案和解析>>
科目:高中化学 来源: 题型:
锌锰干电池由于其贮存和使用寿命较短,大都为一次性电池,用完之后被当作垃圾扔掉。这不仅浪费了宝贵的金属资源,而且还会产生严重的环境污染。下表是各类电池的综合成分分析结果:
| 元素 | 锌[来源:全,品…中&高*考+网] | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
通过简单的机械处理,将电池中各组分进行最大在限度的分离,从而使整个处理过程得到简化。再分别对锌皮和锰粉(MnO2)进行湿法处理,通过预处理、浸取、净化等工序制出产品。工艺流程如下图:
查阅资料知各离子沉淀完全的pH为
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
已知:锌元素与铝元素相似,具有两性。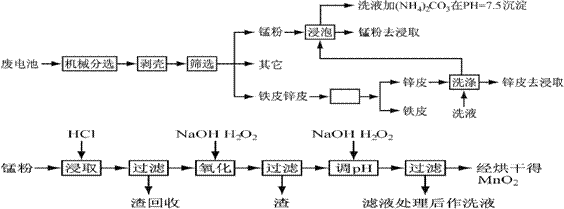
1、市售锌锰干电池为碱性电池,电解质溶液为KOH,则其正极反应为 ;
电极总反应方程为 ;
2、在预处理中,分离铁皮和锌皮的方法是 ,洗液加(NH4)2CO3在pH=7.5沉淀出一种碱式盐,该物质的化学式为 。
3、二氧化锰生产中,写出加入30%盐酸溶解时的离子方程式 ;盐酸溶解后回收的渣是 ;
4、已知第二次加H2O2后调节pH≈9的目的为将Mn2+转化为MnO2,则第一次加H2O2后调节pH≈5,目的是 ;
5、实验室中用高锰酸钾溶液检验Mn2+时,产生黑色沉淀,该反应的离子方程式为
;
6、硫酸锰在高温条件下可以得到三种氧化物,该热分解的方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
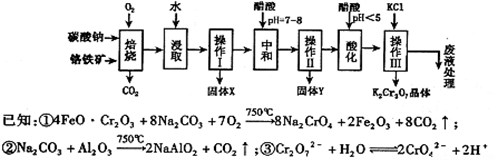
根据题意回答下列问题:
(1)操作Ⅰ的名称是 ,固体X中主要含有 (填写化学式);
(2)用醋酸调节溶液pH=7~8后再进行操作Ⅱ所得固体Y的成分为 (写化学式).
(3)酸化步骤中调节溶液pH<5时发生反应2CrO42-+2H+ 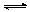 Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
Cr2O72-+H2O.若将将醋酸改用盐酸,盐酸会与Cr2O72-反应造成大气污染并生成Cr3+杂质,该反应的离子方程式为 .
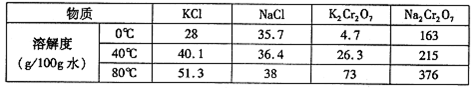
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是
Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是: 。
(5)含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
 ①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
①电解法处理废水的总反应如下,配平并填写空缺:(已知产物中n(Fe(OH)3): n (H2)=1:1)
___Fe+___Cr2O72-+___ +___H2O =___Fe(OH)3↓+___Cr(OH)3↓+___H2↑;
②已知常温下Cr(OH)3的Ksp=6.4×10–32mol4/l4,若Ⅰ类生活饮用水水质标准铬含量最高限值是0.052 mg/L,要使溶液中c(Cr3+)降到符合饮用水水质标准,须调节溶液的pH大于______。
(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
面对能源与环境等问题,
全球大力发展新能源的同时,还倡导节能减排、低碳经济。请回答下列问题:
Ⅰ、氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: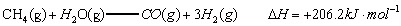
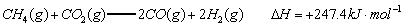
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。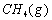 与
与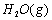 反应生成CO2(g)和
反应生成CO2(g)和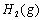 的热化学方程式为 。
的热化学方程式为 。
(2)电解尿素CO(NH2)2的碱性溶液制氢的装置如图所示(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为 。
(3)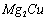 是一种储氢合金。350℃时,
是一种储氢合金。350℃时,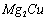 与
与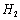 反
反
应,生成MgCu2和仅含一种金属元素的氢化物(其中
氢的质量分数为0.077)。则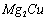 与
与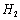 反应的化学
反应的化学
方程式为 。
Ⅱ、碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生可逆反应: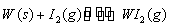 。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的
。为模拟该反应,在实验室中准确称取0.508 g碘、0.6992 g金属钨放置于50.0 mL密闭容器中,在一定温度下反应。如图是混合气体中的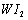 蒸气的物质的量随时间变化关系的图象
蒸气的物质的量随时间变化关系的图象 ,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
,其中曲线I(0~t2时间段)的反应温度为450 ℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
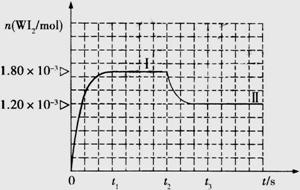
(4)该反应是 (填写“放热”或“吸热”)反应。在450℃时,该反应的平
衡常数K= 。
(5)若保持450℃温度不变,向该容器中再加入0.508 g碘,当再次达到平衡时,反应混合气体中I2的百分含量 (填“变大”、“不变”或“变小”)。
(6)若保持450℃温度不变,向该容器中再加入0.002 mol W、0.000 6 mol I2、0.0054 mol WI2,则化学平衡 (填“正向移动”、“不移动”或“逆向移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
含氮废水进入水体中对环境选成的污染越来越严重。某校环保小组的同学认为可以用金属铝将水中的NO3-还原成N2,从而消除污染。
(1) 配平以下有关的离子反应方程式:
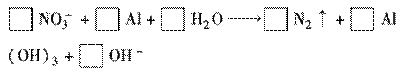
(2)以上反应中失电子的物质是________,还原产物是________,每生成1 mol这种还原产物,将有________电子发生转移。
(3)现需除去1  m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
m3含氮0.3 mol的废水中的NO3-(设氮元素都以NO3-的形式存在),则至少需要消耗金属铝________。
(4)你对以上治理污染的方案有何评价?
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将NaClO3和Na2SO3按物质的量之比2∶1倒入烧瓶中,用水浴加热,同时滴入H2SO4,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为( )
A.Cl2 B.Cl2O
C.ClO2 D.Cl2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com