
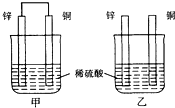
| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中铜片是正极,乙中铜片是负极 | ||
| C. | 两烧杯中溶液的pH均增大 | D. | 甲、乙溶液均变蓝色 |
分析 根据题给装置图知,甲为铜锌原电池,锌作负极,失电子,铜作正极,H+在铜电极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析.
解答 解:根据题给装置图知,甲为铜锌原电池,锌作负极,失电子,铜作正极,H+在铜电极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑;
A、甲为铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,故A错误;
B、乙不构成原电池,铜片不是电极,故B错误;
C、两装置中的反应均为Zn+H2SO4=ZnSO4+H2↑,所以两烧杯的溶液中氢离子浓度均减小,pH均增大,故C正确;
D、甲、乙装置中铜都不参加反应,所以甲、乙溶液都不变蓝,故D错误;
故选:C.
点评 本题考查了置换反应和原电池的有关知识,为高频考点,侧重元素化合物知识的综合理解以及原电池知识的理解和运用的考查,题目难度不大,注意把握原电池的组成条件的工作原理.


科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
下列各组热化学方程式中,△H1>△H2的是( )
①C (s)+O2(g)=CO2(g)△H1 C(s)+1/2O2(g)=CO(g)△H2
(s)+O2(g)=CO2(g)△H1 C(s)+1/2O2(g)=CO(g)△H2
②S(s)+O2(g)=SO2(g)△H1 S(g)+O2(g)=SO2(g)△H2
③H2(g)+1/2O2(g)=H2O(l)△H1 2H2(g)+O2(g)=2H2O(l)△H2
④CaO(s)+H2O(l)=Ca(OH)2(s)△H1 CaCO3(s)=CaO(s)+CO2(g)△H2
A.①④ B.②③ C. ②④ D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若正反应速率V(SO2)=V(SO3).则反应达到平衡 | |
| B. | 若向容器中充入氦气.正、逆反应速率均增大 | |
| C. | 加入催化剂可以同时增加反应物和生成物的活化分子总数 | |
| D. | 到达化学平衡后加热会使正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇存在的共价键总数为10 NA | |
| B. | 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 7.2g新戊烷与异戊烷的混合物中所含极性共价键的数目为1.2NA | |
| D. | 标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4分子的比例模型: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 甲醛分子的电子式: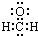 | D. | 基态硫原子的价电子排布:2s22p4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF比HCl稳定是由于HF分子间存在氢键所引起的 | |
| B. | 水在结冰时密度变小是由于水分子间存在氢键所引起的 | |
| C. | CH4分子很稳定,是由于分子间氢键的存在而导致的 | |
| D. | 离子化合物肯定含有金属元素,故在微粒间不存在共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com