
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
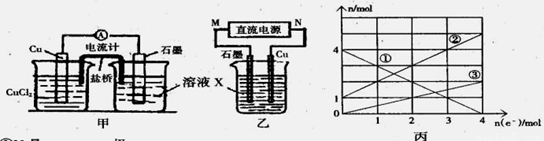
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,则电解时阳极的电极反应式是
。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是
。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
(1)FeCl3和FeCl2 Cu-2e-=Cu2+ K+
(2)负 Fe2+ 2.8
(3) Fe+8OH--6e-=FeO42-+4H2O 2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用。
【解析】
试题分析:(1)根据反应物和生成物可以确定该反应为2FeCl3+Cu=2FeCl2+CuCl2,所以X为FeCl3和FeCl2溶液。Cu做负极,发生的电极反应为Cu-2e-=Cu2+,石墨为正极,阳离子向正极移动,所以K+不断进入X溶液中。
(2)根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,所以M为负极,N为正极,根据转移电子的物质的量和金属阳离子的物质的量的变化,可知①为Fe3+,②为Fe2+,③为Cu2+。当电子转移为2mol时,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+为1mol,所以需要加入NaOH溶液14mol,所以NaOH溶液等体积为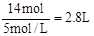 。
。
(3)电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-=FeO42-+4H2O。NaClO氧化Fe(OH)3的反应方程式为2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。Na2FeO4能消毒、净水的原因高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用。
考点:原电池电解原理
点评:本题综合性强,难度大,主要考查学生分析问题的能力,是高考的热点习题。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010-2011学年贵州省高三五校第五次联考(理综)化学部分 题型:选择题
某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。已知0.1mol KBrO3在反应中得到0.5mol电子生成X,则下列说法错误的是
A.氧化产物与还原产物的计量系数之比为5:2 B.氧化性:KBrO3>H3AsO4
C.AsH3 中As元素被氧化,发生氧化反应 D.X的化学式为Br2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。已知0.1mol KBrO3在反应中得到0.5mol电子生成X,则下列说法错误的是
A.氧化产物与还原产物的计量系数之比为5:2 B.氧化性:KBrO3>H3AsO4
C.AsH3 中As元素被氧化,发生氧化反应 D.X的化学式为Br2
查看答案和解析>>
科目:高中化学 来源:2011届贵州省高三五校第五次联考(理综)化学部分 题型:单选题
某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。已知0.1mol KBrO3在反应中得到0.5mol电子生成X,则下列说法错误的是
| A.氧化产物与还原产物的计量系数之比为5:2 | B.氧化性:KBrO3>H3AsO4 |
| C.AsH3中As元素被氧化,发生氧化反应 | D.X的化学式为Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com