

| A. | 元素f位于第三周期第Ⅲ族 | |
| B. | 离子的半径大小为r(d2一)>r(e+) | |
| C. | 元素g的最高价氧化物对应水化物的酸性比h的强 | |
| D. | 由x、z组成的一种四原子化合物的电子式为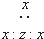 |
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
A.主族元素周期数=电子层数、主族族序数=最外层电子数;
B.电子层结构相同的离子,核电荷数越大离子半径越小;
C.元素非金属性越强,最高价含氧酸的酸性越强;
D.氨气为共价化合物,N原子最外层达到8电子稳定结构.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,
A.f为Al,处于第三周期ⅢA族,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径r(Na+)<r(O2-),故B正确;
C.非金属性S<Cl,元素非金属性越强,最高价含氧酸的酸性越强,故酸性强弱是H2SO4<HClO4,故C错误;
D.z、x形成的化合物为NH3,氨气正确的电子式为: ,故D错误;
,故D错误;
故选B.
点评 本题考查结构性质位置关系综合应用,题目难度中等,根据化合价与原子半径推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| B. | 燃放烟花炮竹会加剧“雾霾”的形成,当“雾霾”中粉尘颗粒直径小于2.5 μm时,可能发生丁达尔效应 | |
| C. | 陶瓷、水泥、玻璃、大理石属于硅酸盐产品 | |
| D. | 光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉和稀盐酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 稀硫酸和Ba(OH)2溶液混合:SO42-+Ba2+═BaSO4↓ | |
| C. | CuSO4和NaOH溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| D. | 单质铜和AgNO3溶液反应:Cu+2Ag+═Cu2++2Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
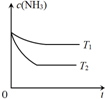 氨是一种重要的化工产品.
氨是一种重要的化工产品.| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、棉花、PVC、淀粉都是混合物 | |
| B. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂与还原剂的物质的量之比是2:1 | |
| B. | 当生成22.4LSO2气体时,转移的电子数目是2NA | |
| C. | 该反应写成离子式是Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu+SO2↑+2H2O | |
| D. | 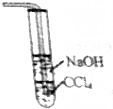 制备SO2装置尾气可用如图处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后用冷水洗涤 | |
| B. | 最简式为C2H4O的有机物一定可以发生银镜反应 | |
| C. | 不粘锅表面的高分子涂层可以由四氟乙烯通过缩聚反应合成 | |
| D. | 甘油和甲苯只有在物质的量之比1:1混合时,充分燃烧后生成的水,才与等质量的甘油充分燃烧后生成的水相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
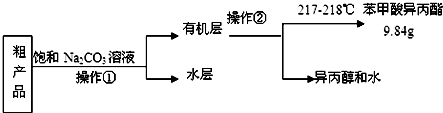
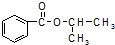 ),已知有关物质的沸点如表:
),已知有关物质的沸点如表:| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 82.4 | 249 | 218 |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com