
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 原子半径:X>Y | |
| B. | 失电子能力:X<Y | |
| C. | 对应简单离子的氧化性:X>Y | |
| D. | X元素的单质跟酸反应置换出氢气比Y容易 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
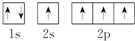
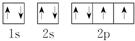
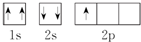
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | RCOOH与R′OH发生酯化反应时生成R′OOCR | |
| B. | 能与NaOH溶液反应,分子式为C2H4O2的有机物一定是羧酸 | |
| C. | 甲酸乙酯、乙酸甲酯、丙酸互为同分异构体 | |
| D. | 甲醛与乙酸乙酯的最简式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com