
在下面的电子结构中,第一电离能最小的原子可能是 ( )
A ns2np3 B ns2np5 C ns2np4 D ns2np6
科目:高中化学 来源: 题型:
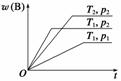
密闭容器中进行的可逆反应:aA(g)+bB(g) cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是 ( )
A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
A是芳香烃的含氧衍生物。为了测定其分子组成,进行如下实验:
①在一定温度和压强下将A气化,其气体的质量是同温、同压下等体积氦气质量的38倍;
②称取7.6gA,在11.2L氧气中完全燃烧,其产物只有CO2和水蒸气。将反应后的混合气 通
过浓硫酸后体积为10.64L,浓H2SO4质量增加3.6g。再将余下的气体通过盛有足量Na2O2的干燥管后,气体体积减少至6.16L(气体体积均在标准状况下测定)。试回答:
(1)A的分子式为 ;
(2)A物质苯环上只有一取代基,遇FeCl3溶液无显色反应。1molA只能与1molNaHCO3反应;1molA与足量Na反应生成1molH2。则A的结构简式为 ;
(3)A与足量钠反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于某有机物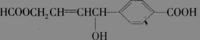 的性质叙述正确的是 ( )
的性质叙述正确的是 ( )
A、1 mol该有机物可以与3 mol Na发生反应、
B、1 mol该有机物可以与3 mol NaOH发生反应
C、1 mol该有机物可以与6 mol H2发生加成反应
D、1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
液晶高分子材料应用广泛,新型液晶基元﹣﹣化合物IV的合成线路如下:
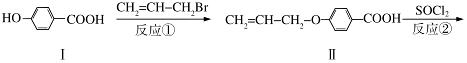

(1)化合物Ⅰ的分子式为 ,1mol化合物Ⅰ最多可与 mol NaOH反应。
(2)CH2=CH﹣CH2Br与NaOH水溶液反应的化学方程式为 (注明条件)。
(3)化合物I的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式 (任写一种)。
(4)反应③的反应类型是 .在一定条件下,化合物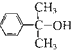 也可与III发生类似反应③的反应生成有机物V,V的结构简式是 。
也可与III发生类似反应③的反应生成有机物V,V的结构简式是 。
(5)下列关于化合物Ⅳ的说法正确的是 (填字母)。
A.属于烯烃 B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应 D.能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子排布式的原子中,半径最大的是 ( )
A ls22s22p63s23p5 B 1s22s22p63s23p2 C 1s22s22p2 D 1s22s22p63s23p4
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素基态原子核外电子排布式为________,该元素的名称是________。
(2)Y元素原子价电子排布图为 。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________。
(4)已知由元素X与镓元素组成的化合物A为第三代半导体。已知化合物A的晶胞结构与金刚石相似,其中X原子位于立方体内,镓原子位于立方体顶点和面心,请写出化合物A的化学式 ;化合物A可由(CH3)3Ga和XZ3在700℃下反应制得,反应的化学方程式为 。
(5)已知铝与镓元素位于同一主族,金属铝属立方晶系,其晶胞边长为405 pm,密度是2.70g·cm-3,通过计算确定其晶胞的类型 (填简单、体心或面心立方);晶胞中距离最近的铝原子可看作是接触的,计算铝的原子半径r(A1)= pm。(列出算式即可,已知:4053≈6.64×107)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A. 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动
B.铅蓄电池在放电过程中,负极质量增加,正极质量减少
C.100 mL pH=3的HA溶液、HB溶液分别与足量的锌反应,HA溶液放出的氢气多,说明HA的酸性比HB的 弱
弱
D.已知I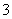
 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是
A.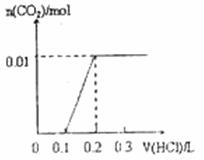 B.
B.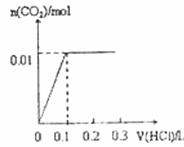
C.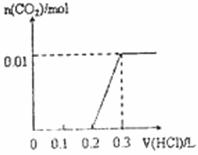 D.
D.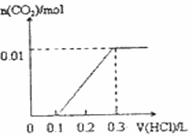
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com