
| A. | 澄清透明的溶液中:MnO${\;}_{4}^{-}$、SO${\;}_{4}^{2-}$、K+、Fe3+ | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 3%H2O2溶液中:Fe2+、H+、SO${\;}_{4}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1的Na2SO3溶液中:K+、H+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ |
分析 A.该组离子之间不反应;
B.c(H+)=1×10-13mol/L的溶液,显碱性;
C.离子之间发生氧化还原反应;
D.离子之间发生氧化还原反应.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.c(H+)=1×10-13mol/L的溶液,显碱性,碱性溶液中不能大量存在Mg2+、Cu2+,故B错误;
C.Fe2+、H+、H2O2发生氧化还原反应,不能大量共存,故C错误;
D.SO32-、H+、NO3-发生氧化还原反应,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 化学能与电能的相互转化必须通过一定的装置 | |
| B. | 任何化学反应都伴随有能量的变化 | |
| C. | 能源的开发和利用情况可以衡量一个国家或地区的经济发展和科学技术水平 | |
| D. | 太阳能、风能、氢能、电能都是可再生的新能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=$\frac{{Q}_{1}}{2}$ | B. | Q2<$\frac{{Q}_{1}}{2}$ | C. | Q2>$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
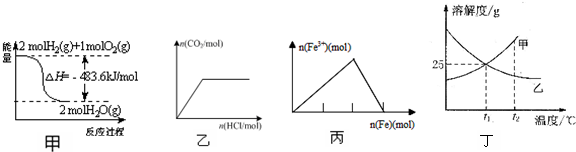
| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ•mol-1 | |
| B. | 乙表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系 | |
| C. | 丙表示在稀硝酸溶液中加入铁粉,溶液中Fe3+浓度的变化曲线 | |
| D. | 丁表示t1℃时质量分数均为20%的甲、乙两种溶液,升温到t2℃时,两种溶液中溶质的质量分数仍然相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 目的 |
| A | 取4gNaOH固体溶入100mL水中 | 配制4mol•L-1NaOH溶液 |
| B | 向沸水中逐滴加入1~2mLFeCl3饱和溶液,搅拌并继续煮沸出现浑浊 | 制备Fe(OH)3胶体 |
| C | 测定等物质的量浓度的盐酸、硝酸的pH | 比较Cl、N的非金属性强弱 |
| D | 用熔融氧化铝、CCl4做导电性实验 | 验证两者是离子化合物还是共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加饱和FeCl3溶液,溶液呈红褐色:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | NaClO溶液中通入过量SO2:ClO-+SO2+H2O═HClO+HS03- | |
| C. | 用铜作电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 向明矾溶液中滴加少量Ba(OH)2:2Al3++3SO4 2-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com