
| A. | 1 mol CO2和1 mol CO所占的体积相同,所含分子数相同 | |
| B. | 1 g CO和1 g CO2所占的体积不同,所含分子数不同 | |
| C. | 在任何情况下,1 mol CO2和64 g SO2所含有分子数和原子总数都相同 | |
| D. | 某物质若含阿伏加德罗常数个微粒,该物质标准状况下体积约为22.4 L |
分析 A、状况不知,无法求体积的大小;
B、状况不知,无法比较体积的大小;
C、64 g SO2的物质的量为1mol,而二氧化硫与二氧化碳都是三原子分子;
D、状态不知;
解答 解:A、状况不知,无法求体积的大小,所以1 mol CO2和1 mol CO所占的体积在相同条件下相同,所含分子数相同,故A错误;
B、状况不知,无法比较体积的大小,所以1 g CO和1 g CO2在相同条件下所占的体积不同,所含分子数不同,故B错误;
C、64 g SO2的物质的量为1mol,而二氧化硫与二氧化碳都是三原子分子,所以1 mol CO2和64 g SO2所含有分子数和原子总数都相同,故C正确;
D、某气态物质若含阿伏加德罗常数个微粒,该物质标准状况下体积约为22.4 L,故D错误;
故选C.
点评 本题考查阿伏伽德罗定律及应用,为高频考点,把握温度、压强、体积的关系为解答的关键,侧重分析与应用能力的考查,注意气体体积的影响因素,题目难度不大.


科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
(每空3分,共6分)根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,写出表示硫的燃烧的热化学方程式:______________。
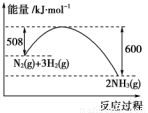
(2)如图是298 K、101 kPa时,N2与H2反应过程中能量变化的曲线图。该反应的热化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1 mol·L-1的NaOH溶液。整个实验过程中pH变化如图所示,下列有关叙述正确的是
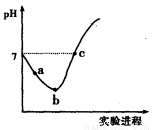
A.实验进程中可用pH试纸测定溶液的pH
B.a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
C.c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.由a点到b点的过程中,溶液中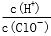 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H-H | 436 |
| O-H | 463 |
| O=O | 498 |
 .
.| 实验编号 | 反应物 | 催化剂 | |
| a | 50mL 5% H2O2溶液 | 1mL 0.1mol•L-1 FeCl3溶液 | |
| b | 50mL 5% H2O2溶液 | 少量浓盐酸 | 1mL 0.1mol•L-1 FeCl3溶液 |
| c | 50mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1mL 0.1mol•L-1 FeCl3溶液 |
| d | 50mL 5% H2O2溶液 | MnO2 | |
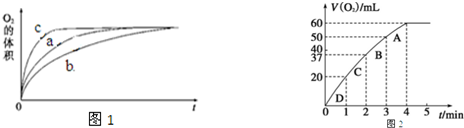
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
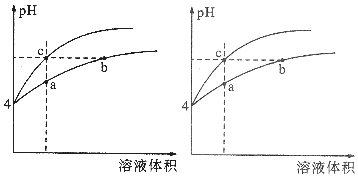 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )| A. | a、c两点溶液的导电能力相同 | |
| B. | b点溶液中c(H+)+c(NH3•H2O)=c(OH-) | |
| C. | 用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc | |
| D. | a、b、c三点溶液中水的电离程度a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
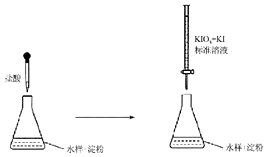 含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.
含硫化合物在生产生活中应用广泛,科学使用对人体健康及环境保持意义重大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 | |
| B. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 | |
| C. | 25℃时,Mg(OH)2固体在20 mL 0.01 mol•L-1氨水中的Ksp比在20 mL 0.01 mol•L-1 NH4Cl溶液中的Ksp小 | |
| D. | 25℃时,向二者的饱和溶液中分别加水,平衡均向沉淀溶解方向移动,c(Mg2+)均增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com