
一定条件下,2SO2(g)+O2(g) 2SO3(g) △H<0,有关叙述正确的是
2SO3(g) △H<0,有关叙述正确的是
A.升高温度,v(正)变大,v(逆)变小
B.恒温恒容,充人O2,02的转化率升高
C.恒温恒压,充人N2,平衡不移动
D.恒温恒容,平衡前后混合气体的密度保持不变
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
类推思维是化学解题中常用的一种思维方法.下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀硫酸加入Ba(OH)2溶液至中性 2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O | NaHSO4溶液加入Ba(OH)2溶液至中性 H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O |
| C | 向氯化铝溶液中加入足量NaOH溶液 Al3++4OH﹣═AlO2﹣+2H2O | 向氯化铝溶液中加入足量氨水 Al3++4NH3•H2O═AlO2﹣+2H2O+4NH4+ |
| D | 向Ca(OH)2溶液中通入过量CO2 CO2+OH﹣═HCO3﹣ | 向Ca(OH)2溶液中通入过量SO2 SO2+OH﹣═HSO3﹣ |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
( )
|
| A. | ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓ |
|
| B. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
|
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
|
| D. | d点溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 L HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol/l,向该溶液中加入足量铜粉,加热,充分反应,当HNO3与H2SO4的物质的量比为x:y 时所得溶液中Cu2+物质的量浓度最大,则x:y为
A.2:3 B.3:8 C.1:4 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=== +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应: +Ca2++2OH-===CaCO3↓+
+Ca2++2OH-===CaCO3↓+ +2H2O
+2H2O
C.浓盐酸酸化的KMnO4溶液与H2O2反应: +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++ +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2), 某小组同学设计了如图所示装置(夹持仪器和连接用的乳胶管已经省略)。
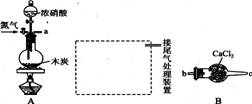

(1)为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a→( )( ) →( )( ) →( )( ) →( )( )(填仪器接口的字母编号)。连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通人氮气的主要目的是 。
(2)简述使用分液漏斗向圆底烧瓶中滴加浓硝酸的操作: 。装置E中观察到的主要实验现象有 。
(3)装置C的作用是 。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成: (写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I一氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| |温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0. 10 mol/L NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32-
B.25℃时,加水稀释后,n(H+)与n( OH-)的乘积变大
C.离子浓度关系:c( Na+)+c(H+)=c( OH-)+c( HCO3- )+c( CO32-)
D.温度升高,c(HCO3-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com