
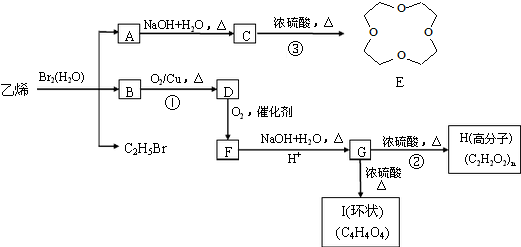
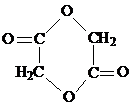 .
.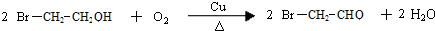 .写出反应 ②的化学方程式
.写出反应 ②的化学方程式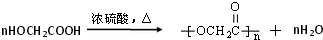 .
.分析 溴和水反应生成氢溴酸和次溴酸,氢溴酸和乙烯发生加成反应生成溴乙烷,次溴酸和乙烯发生加成反应生成B,B的结构简式为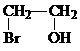
 ,以C2H5Br为原料,制备乙酸乙酯,可以先将C2H5Br水解得到乙醇,乙醇氧化得乙醛,再氧化得乙酸,乙酸与乙醇发生酯化反应得乙酸乙酯,据此答题.
,以C2H5Br为原料,制备乙酸乙酯,可以先将C2H5Br水解得到乙醇,乙醇氧化得乙醛,再氧化得乙酸,乙酸与乙醇发生酯化反应得乙酸乙酯,据此答题.
解答 解:溴和水反应生成氢溴酸和次溴酸,氢溴酸和乙烯发生加成反应生成溴乙烷,次溴酸和乙烯发生加成反应生成B,B的结构简式为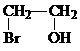
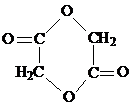
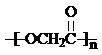
 ,
,
(1)B的结构简式为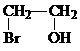
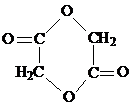
故答案为:溴原子、羟基;取代反应;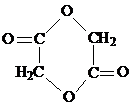
(2)反应 ①的化学方程式为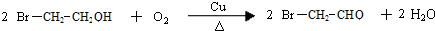 ,反应②的化学方程式为
,反应②的化学方程式为 ,
,
故答案为: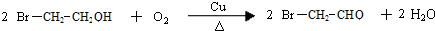 ;
; ;
;
(3)以C2H5Br为原料,制备乙酸乙酯,可以先将C2H5Br水解得到乙醇,乙醇氧化得乙醛,再氧化得乙酸,乙酸与乙醇发生酯化反应得乙酸乙酯,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,根据物质官能团结合题给信息进行分析解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
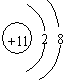 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
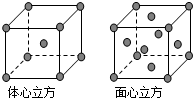 A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱与醋酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 等物质的量的SO2和Cl2通入水中:SO2+Cl2+2H2O=4H++SO42-+2Cl- | |
| C. | NH4HCO3溶液与过量的浓NaOH溶液反应:NH4++OH-=NH3↑+H2O | |
| D. | 锌与稀硝酸反应:Zn+2H+=Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8mol | B. | <0.9mol | ||
| C. | 0.9mol | D. | 在0.9mol和1.8mol之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>Cl>S | B. | 熔点:SiO2>KCl>I2 | ||
| C. | 稳定性:HF>H2S>H2O | D. | 碱性:KOH>NaOH>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①⑥⑦ | C. | ②④⑦ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com