
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。现用该浓硫酸配制100 mL 1 mol/L的稀硫酸。可供选用的仪器有:

①胶头滴管;②烧瓶;③烧杯;④ 药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有 (选填序号),
还缺少的仪器有 (写仪器名称);
(2)经计算,配制100mL1mol/L的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL(保留一位小数),量取浓硫酸时应选用 (选填①10mL、②50mL 、③100mL)规格的量筒;
(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则导致最后所得溶液的浓度___ _____ (填“偏高”、“偏低”或“无变化”,下同)。②定容时俯视容量瓶的刻度线,则所配得的溶液浓度_____ 。
(1) ② ④ ⑥;100mL容量瓶 玻璃棒;; (2) 5.4;①;(3)偏低;偏高
【解析】
试题分析:(1)配制100 mL 1 mol/L的稀硫酸时,上述仪器中需要使用的有①胶头滴管;③烧杯;⑤量筒,不需要使用的仪器是②烧瓶;④ 药匙;⑥托盘天平。(2)浓硫酸的物质的量浓度是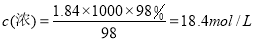 溶液在稀释前后溶质的物质的量不变,18.4mol/L×V= 100ml×1mol/L.解得v= 5.4ml即浓硫酸的体积为5.4ml。量取浓硫酸时应选用规格与量取的体积接近的量筒,选用①10mL规格的量筒;(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则会因为溶质的损失导致最后所得溶液的浓度偏低;②定容时俯视容量瓶的刻度线,则由于溶液的体积少所配得的溶液浓度偏高。
溶液在稀释前后溶质的物质的量不变,18.4mol/L×V= 100ml×1mol/L.解得v= 5.4ml即浓硫酸的体积为5.4ml。量取浓硫酸时应选用规格与量取的体积接近的量筒,选用①10mL规格的量筒;(3)①配制过程中,若将洗涤烧杯所得的溶液直接倒入废液缸中,则会因为溶质的损失导致最后所得溶液的浓度偏低;②定容时俯视容量瓶的刻度线,则由于溶液的体积少所配得的溶液浓度偏高。
考点:考查物质的量浓度的溶液的配制使用的仪器的选择、误差分析、与溶液的质量分数的换算的知识。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2013-2014吉林省长春市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)=== C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g) △H2。则△H1>△H2
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:填空题
(6分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答 下列问题:
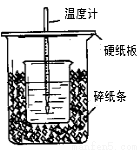
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、
无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”);所求中和热_______ (填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
体积恒定的密闭容器中,反应2SO2(g)+O2(g)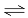 2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
2SO3(g) △H <0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
A.通入大量O2B.增大容器容积C.移去部分SO3D.降低体系温度
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
下列表述中,合理的是( )
A.将水加热,Kw不变,pH不变
B.把FeCl3的水溶液加热蒸干可得到FeCl3固体
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+, Sn2++2Fe3+===2Fe2++Sn4+;由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ge3+ B.Sn2+、Ge3+、Fe2+
C.Ge3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ge3+
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为
A.0.1 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
把一块镁铝合金投入到1 mol/L酸中,待合金完全溶解后,再往溶液里加入1 mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积变化的关系如下图所示,下列说法中错误的是( )
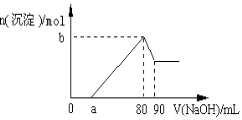
A.盐酸的体积为80ml B.a的取值范围为0≤ a <50
C.n(Mg2+)<0.025mol D.当a值为30时,b值为0.01
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列对钢铁制品采取的措施不能防止或减缓钢铁腐蚀的是( )
A.保持表面干燥 B.表面镀锌
C.表面镶嵌铜块 D.与电源负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com