
| A. | 共价化合物的熔沸点都比较低 | |
| B. | 氢的三种核素可组成6种水分子 | |
| C. | H2O分子比H2S分子稳定的原因,是H2O分子间存在氢键 | |
| D. | SiO2和CaCO3在高温下反应生成CO2气体,说明硅酸的酸性比碳酸强 |
分析 A.共价化合物包括分子晶体和原子晶体;
B.根据水分子的构成分析判断,构成水分子的氢原子可能相同也可能不同;
C.分子的稳定性与氢键无关;
D.常温下,水溶液中酸性强的酸能制取酸性弱的酸.
解答 解:A.共价化合物包括分子晶体和原子晶体,而物质的熔点的一般顺序为:原子晶体>离子晶体>分子晶体,故离子化合物的熔点不一定比共价化合物的高,故A错误;
B.由O与11H、21H、31H三种核素最多可能组成11H2O、21H2O、31H2O、11H21HO、11H31HO、21H31HO 共6种水分子,故B正确;
C.分子的稳定性与氢键无关,氢键决定分子的物理性质,分子的稳定性与共价键有关,故C错误;
D.常温下,水溶液中酸性强的酸能制取酸性弱的酸,SiO2和CaCO3在高温下反应生成CO2气体是高温条件下的反应,不说明硅酸的酸性比碳酸强,故D错误.
故选B.
点评 本题考查了熔点的比较、核素、氢键和共价键等,题目难度不大,侧重于考查学生对基础知识的应用能力,注意把握氢键对物质性质的影响.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 减少CO2的排放,可以减少酸雨的产生 | |
| B. | 用SO2漂白纸浆和草帽辫,该过程发生了氧化还原反应 | |
| C. | 明矾净水的原理和“84”消毒液的原理不相同 | |
| D. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的主要材料是经提纯的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为避免废旧电池中重金属对环境的污染,可将其深埋 | |
| B. | 为防止海鲜产品腐烂,可将其浸泡在甲醛溶液中 | |
| C. | 利用太阳能代替化石燃料,可改善空气质量 | |
| D. | 利用催化剂可将汽车尾气全部转化为无害气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=l.0时,反应的离子方程式为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当a=2时,反应的离子方程式为:Ba2++3OH-+2CO2═BaCO3↓+HCO3-+H2O | |
| C. | 当a=2.5时,反应的离子方程式为:OH-+CO2═HCO3- | |
| D. | 当a=1.75时,溶液中HCO3-与CO32-的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现 象 | 结 论 |
| A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(ClO)2溶液 | 生成白色沉淀 | 试样己氧化变质 |
| B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3>Cl2 |
| C | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测溶液中含有Fe2+ |
| D | 向Na2SO4和Na2CO3混合溶液中滴入AgNO3溶液 | 产生白色沉淀 | Ksp(Ag2SO4)<Ksp(Ag2CO3) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验器材 | 相应实验 |
| A | 试管、铁架台、导管、酒精灯 | 乙酸乙酯的制备 |
| B | 锥形瓶、漏斗、双孔塞、导管、带余烬的木条、药匙 | 检验MnO2对H2O2分解速率的影响 |
| C | 500mL容量瓶、烧杯、玻璃棒、天平 | 配制 500mL1.00mol/LNaCl溶液 |
| D | 三脚架、坩埚、酒精灯、坩埚钳 | 钠在空气中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
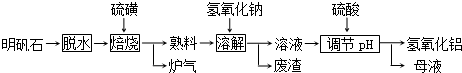
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
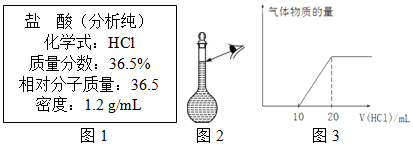
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com