
.纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:
;
(2)写出“联合制碱法”有关反应的化学方程式:
;
;
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%)= 。
【答案】
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O+NaCl(饱和)=NaHCO3↓+NH4Cl
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(或写总反应方程式:2NaCl+2NH3+CO2+H2O=Na2CO3+2NH4Cl)
(3)“氨碱法”的CO2来源于石灰石煅烧,“联合制碱法”的CO2来源于合成氨工业的废气;
(4)“联合制碱法”原子利用率的表达式:
原子利用率(%)= =
=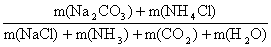 ×100%或
×100%或
原子利用率(%)=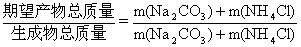 ×100%
×100%
【解析】这是一道化学与工业生产相结合的试题,本题主要考查“氨碱法”和“联合制碱法”的工艺原理。氨碱法为了使原料NH3循环使用,造成大量废渣CaCl2,联合制碱法可制得化工产品NH4Cl,同时提高了NaCl的利用率。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
某酸性工业废水中含有 。光照下,草酸
。光照下,草酸 能将其中的
能将其中的 转化为
转化为 。某课题组研究发现,少量铁明矾
。某课题组研究发现,少量铁明矾 即可对该反应堆起催化作用。
即可对该反应堆起催化作用。
为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。

测得实验①和②溶液中的 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;实验①中 时间段反应速率
时间段反应速率 (
( )=
)=
 (用代数式表示)。
(用代数式表示)。
(4)该课题 组队铁明矾
组队铁明矾 中起催化作用的成分提出如下假设,请你完成假设二和假设三:
中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一: 起催化作用;
起催化作用;
假设二: ;
假设三: ;
…………
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有 等。溶液中
等。溶液中 的浓度可用仪器测定)
的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质18 g,则该氧化物粉末可能是( )
A.Fe2O3和MnO2 B.MnO2和V2O5
C.Cr2O3和V2O5 D.Fe3O4和FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL浓度为0.50mol/L的HCl溶液中和,则该生成物的成分是
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中,对陈述I、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是
| 选项 | 陈述I | 陈述Ⅱ | 判断 |
| A | 工业生产硫酸用水吸收SO3 | SO3可与水反应 | I对;Ⅱ对;有 |
| B | Cl2和SO2混合后可用于漂白纸浆 | Cl2和SO2都有较好的漂白作用 | I对;Ⅱ错;无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的光 | I对;Ⅱ对;无 |
| D | 石墨常用作电解池的电极 | 石墨的化学性质稳定且导电性好 | I对;Ⅱ对;有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
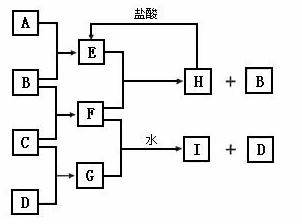
请填写下列空白:
(1)A是 ,C是 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液的反应生成I和D的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1∶1和
1∶2。高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入NaOH溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是
(2)B煅烧生成C和D的化学方程式是
甲元素的单质与F溶液反应的离子方程式是
(3)往G溶液中加入NaOH溶液发生的现象是
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、
Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中最终无沉淀;
(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中:
① 肯定含有的离子是 ;
② 肯定不存在的离子是 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com