
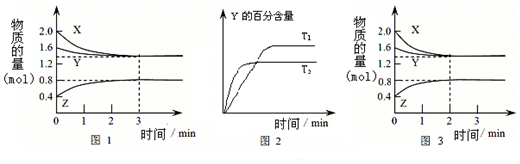
| A. | 容器中发生的反应可表示为:2X(g)+Y(g)?2Z(g) | |
| B. | 0~3 min内,v(X)=0.2 mol•L-1•min-1 | |
| C. | 其他条件不变升高温度,v正、v逆都增大,且重新平衡前v正>v逆 | |
| D. | 若改变条件,使反应进程如图3所示,则改变的条件可能是增大压强 |
分析 A、根据物质的量的变化量与化学计量数成正比书写化学方程式;
B、根据3min内X的物质的量浓度的变化量计算化学反应速率;
C、根据图2中曲线的斜率大小判断温度的高低;
D、图3与图1比较,判断平衡是否发生移动,根据影响平衡移动的因素判断.
解答 解:A、根据图1分析,反应中X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,所以X、Y为反应物,Z为生成物,由于该反应反应物没有完全反应,该反应为可逆反应,根据物质的量的变化量与化学计量数成正比可知0.4mol:0.2mol:0.4mol=3:1:2,所以反应的化学方程式为3X(g)+Y(g) 2Z(g),故A错误;
2Z(g),故A错误;
B、反应进行的前3min内,v(X)=$\frac{\frac{2.0mol-1.4mol}{2L}}{3min}$=0.1mol/(L•min),故B错误;
C、根据图2中曲线的斜率大小判断,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,v正>v逆,故C正确;
D、图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故D错误.
故选C.
点评 本题考查化学平衡移动以及平衡图象题,做题时注意分析图象中曲线的变化规律,结合外界条件对平衡移动的影响进行分析,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
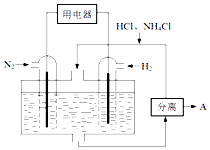 氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.
氮及其化合物在工农业生产生活中应用广泛,请解决下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3+NaCl═AgCl↓+NaNO3 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | MgCl2(熔融)$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ | D. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的燃烧热△H=+297.2 kJ•mol-1 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量高于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在空气中充分燃烧,可释放148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内amol A生成,同时生成3amol B | |
| C. | 容器内的压强不再变化 | |
| D. | 混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
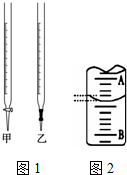 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com