
【题目】已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.混合溶液的pH=7
B.混合溶液中,c(H+)= ![]() mol/L
mol/L
C.a=b
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
【答案】B
【解析】解:A.因温度未知,则pH=7不一定为中性,故A错误;B、混合溶液中,c(H+)= ![]() mol/L,根据c(H+)c(OH﹣)=KW , 可知溶液中c(H+)=c(OH﹣)═
mol/L,根据c(H+)c(OH﹣)=KW , 可知溶液中c(H+)=c(OH﹣)═ ![]() mol/L,溶液呈中性,故B正确;
mol/L,溶液呈中性,故B正确;
C.因酸碱的强弱未知,a=b,只能说明酸碱恰好完全反应,但如为强酸弱碱盐或强碱弱酸盐,则溶液不呈中性,故C错误;
D.任何溶液都存在电荷守恒,即c(H+)+c(B﹣)=c(OH﹣)+c(A﹣),不能确定溶液的酸碱性,故D错误.
故选B.
温度T时水的离子积常数为KW , 浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,若溶液呈中性,反应后的溶液中应存在c(H+)=c(OH﹣)= ![]() mol/L.
mol/L.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】【化学﹣选修3物质结构与性质】 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
(1)基态硒原子的价层电子排布式为 .
(2)锗、砷、硒的第一电离能大小排序为 . H2SeO4的酸性比H2SeO3的强,其原因是 .
(3)H2SeO3的中心原子杂化类型是;SeO32﹣的立体构型是 . 与SeO42﹣互为等电体的分子有(写一种物质的化学式即可) .
(4)H2Se属于(填:极性或非极性)分子;单质硒的熔点为217℃,它属于晶体.
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为;若该晶胞密度为ρgcm﹣3 , 硒化锌的摩尔质量为M g/mol.NA代表阿伏加德罗常数,则晶胞参数a为pm. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. CO2、CCl4、CH4三个分子中所有原子都满足最外层8电子结构
B. 第ⅠA族的金属元素形成的单质的熔点随原子序数的递增而降低
C. 第ⅦA族元素形成的单质的熔点随原子序数的递增而降低
D. 第ⅠA族元素燃烧形成的氧化物中氧的化合价都不是-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是维持生命的最基本条件。以下有关水的说法错误的是( )
A. 自由水在人体内是良好的溶剂
B. 衰老的细胞水分减少
C. 人体内废物的排出需要水
D. 代谢旺盛时,结合水与自由水的比值升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目: 。该反应中,是还原剂,是还原产物,被还原的物质是。
(2)在一定条件下,反应2NH3+3CuO ![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2=3S+2H2O中被氧化的元素与被还原的元素的质量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3﹣0.5n]m , 广泛用于污水处理.实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO47H2O )过程如下: 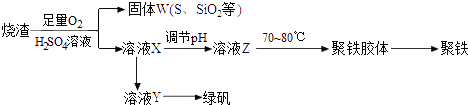
(1)验证固体W焙烧后产生的气体含有SO2的方法是 .
(2)实验室用铜和浓硫酸制备、收集干燥的SO2 , 所需仪器如下. 
装置A产生SO2 , 按气流方向连接各仪器接口,顺序为a→→→→→f,装置A中发生反应的化学方程式为 .
(3)制备绿矾时,向溶液X中加入过量 , 充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾.
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用(填“酸式”或“碱式”)滴定管.
(5)溶液Z的pH影响聚铁中铁的质量分数,若溶液Z的pH偏小,将导致聚铁中铁的质量分数(填“偏大”、“偏小”或“无影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com