
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
| PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体,遇水均剧烈水解为含氧酸和氯化氢,两者互溶 |
| POCl3 | 2.0 | 106.0 | 153.5 |
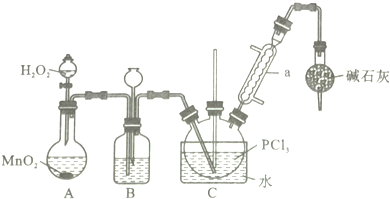
分析 I.A装置中用双氧水与二氧化锰反应生成氧气,通过加入双氧水的量,可以控制产生氧气的速率,氧气中含有水蒸气用浓硫酸除去,所以B装置中装浓硫酸,装置B中有上颈漏斗,可以平衡装置内外的压强,起安全瓶的作用,纯净的氧气与三氯化磷反应生成POCl3,为了控制反应速率且要防止三氯化磷会挥发,反应的温度控制在60~65℃,所以装置C中用水浴,为防止POCl3挥发,用冷凝管a进行冷凝回流,POCl3遇水均剧烈水解为含氧酸和氯化氢,所以为防止空气中水蒸汽进入装置,同时吸收尾气,所以在装置的最后连有碱石灰的干燥管;
II.测定POCl3产品含量,用POCl3与水反应生成氯化氢,然后用硝酸银标准溶液沉淀溶液中的氯离子,KSCN溶液滴定过量的AgNO3溶液,根据KSCN的物质的量可计算出溶液中剩余的AgNO3,结合AgNO3的总物质的量得知与氯离子反应的硝酸银,进而计算出溶液中氯离子的物质的量,根据元素守恒可计算出样品中POCl3的质量,进而确定POCl3的质量分数,据此答题.
解答 解:I.A装置中用双氧水与二氧化锰反应生成氧气,通过加入双氧水的量,可以控制产生氧气的速率,氧气中含有水蒸气用浓硫酸除去,所以B装置中装浓硫酸,装置B中有上颈漏斗,可以平衡装置内外的压强,起安全瓶的作用,纯净的氧气与三氯化磷反应生成POCl3,为了控制反应速率且要防止三氯化磷会挥发,反应的温度控制在60~65℃,所以装置C中用水浴,为防止POCl3挥发,用冷凝管a进行冷凝回流,POCl3遇水均剧烈水解为含氧酸和氯化氢,所以为防止空气中水蒸汽进入装置,同时吸收尾气,所以在装置的最后连有碱石灰的干燥管,
(1)根据装置图可知,仪器a的名称为 冷凝管,
故答案为:冷凝管;
(2)装置C中生成POCl3的化学方程式为PCl3+H2O2=POCl3+H2O,
故答案为:PCl3+H2O2=POCl3+H2O;
(3)实验中控制通入O2的速率的操作是控制分液漏斗中双氧水的加入量,
故答案 为:控制分液漏斗中双氧水的加入量;
(4)装置B中装有浓硫酸,其作用是观察O2的流速、平衡气压、干燥氧气,
故答案为:平衡气压、干燥氧气;
(5)根据上面的分析可知,反应温度应控制在60~65℃,原因是温度过低,反应速率小,温度过高,三氯化磷会挥发,影响产物纯度,
故答案为:温度过低,反应速率小,温度过高,三氯化磷会挥发,影响产物纯度;
II.测定POCl3产品含量,用POCl3与水反应生成氯化氢,然后用硝酸银标准溶液沉淀溶液中的氯离子,KSCN溶液滴定过量的AgNO3溶液,根据KSCN的物质的量可计算出溶液中剩余的AgNO3,结合AgNO3的总物质的量得知与氯离子反应的硝酸银,进而计算出溶液中氯离子的物质的量,根据元素守恒可计算出样品中POCl3的质量,进而确定POCl3的质量分数,
(6)以硫酸铁溶液为指示剂,用 KSCN溶液滴定过量的AgNO3溶液达到终点时的现象是溶液变红色,
故答案为:溶液变红色;
(7)KSCN的物质的量为0.2mol/L×0.01L=0.002mol,根据反应Ag++SCN-=AgSCN↓,可知溶液中剩余的银离子的物质的量为0.002mol,POCl3与水反应生成氯化氢的物质的量为3.5×0.01mol-0.002mol=0.033mol,即1.6725g POCl3产品中POCl3的物质的量为0.011mol,所以产品中n(POCl3)=0.11mol,
故答案为:0.11mol;
(8)加入少量硝基苯可以使生成的氯化银沉淀离开溶液,如果不加硝基苯,在水溶液中部分氯化银可以转化成AgSCN,已知Ksp(AgCl)>Ksp(AgSCN),使得实验中消耗的AgSCN偏多,根据(7)的计算原理可知,会使测定结果将偏低,
故答案为:偏低.
点评 本题考查物质制备,为高频考点,涉及含量的测定、物质制备、基本实验操作、仪器使用及名称等知识点,明确实验原理及实验基本操作方法是解本题关键,注意结合实验目的解答,知道装置图中发生的反应及注意事项,题目难度中等.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH2OH | B. | (CH3)2COHCH2CH3 | ||
| C. | (CH3)2CHCH2CH2OH | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴水 | 分液 |
| B | 淀粉溶液(NaCl) | 水 | 过滤 |
| C | CH3CH2OH (CH3COOH) | CaO | 蒸馏 |
| D | CH3COOC2H5 (CH3COOH) | NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取气体时,先装药品,后检查装置的气密性 | |
| B. | 加热KClO3并用排水法收集O2实验结束时,先熄灭酒精灯,后移出导管 | |
| C. | 稀释浓硫酸时,先把浓硫酸倒入烧杯中,后沿器壁缓慢注入水,边加边搅拌 | |
| D. | 加热试管时,先使试管底部均匀受热,后用酒精灯的外焰固定加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉只有氢气产生的溶液中:Na+、SO42-、NO3-、Mg2+、 | |
| B. | 滴加石蕊试液显红色的溶液中:Fe3+、NH4+、Cl-、SCN- | |
| C. | 在0.1mol/L的NaHSO4溶液中:NH4+、Na+、Al3+、Cu2+、NO3- | |
| D. | 在0.1mol/L的NaHCO3溶液中K+、Al3+、Fe3+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com