
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
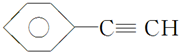 B.CH4
B.CH4分析 元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,结合物质的结构、性质分析解答.
解答 解:元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,
(1)分子中含有sp和sp3 杂化方式,说明分子中中心原子含有2个和4个价层电子对,
A. 中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
B.CH4分子中碳原子含有4个价层电子对,为sp3 杂化,故B错误;
C.CH2=CHCH3分子中,碳碳双键两端的碳原子含有3个价层电子对,为SP2杂化,甲基上碳原子含有4个价层电子对,为sp3杂化,故C错误;
D.CH3CH2C≡CH分子中,碳碳三键两端的碳原子含有2个价层电子对,为SP杂化,甲基和亚甲基上碳原子含有4个价层电子对,为sp3杂化,故D正确;
E.CH3CH3分子中甲基上碳原子含有4个价层电子对,为sp3杂化,故E错误;故选D;
(2)E的氢化物是氟化氢,氟化氢的水溶液中,氟化氢和氟化氢之间能形成氢键,水分子之间能形成氢键,水中氢离子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O,故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(3)AD2与BD2分别是二氧化碳和二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理知,二氧化碳不如二氧化硫易溶于水,故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(4)水分子之间存在氢键,常温下水是液态,而硫化氢为气体,分子内无氢键,故水的沸点较高,元素的非金属性越强,其气态氢化物的热稳定性越高,即水的热稳定性大于硫化氢,故答案为:H2O;H2O.
点评 本题考查了化学式的确定、氢键、原子杂化方式的判断等知识点,这些都是考试热点,知道哪些物质之间能形成氢键、杂化方式的判断方法等即可解答,难度中等.


科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可用如图所示装置进行多个实验探究,请回答下列问题.
实验室可用如图所示装置进行多个实验探究,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH20中含NA个质子 | |
| B. | 1L 1mol•L一1的CuSO4溶液中含NA个Cu2+ | |
| C. | 常温常压下,2.24L Cl2中含0.2NA个氯原子 | |
| D. | 0.5mol Al与足量NaOH溶液充分反应,转移的电子数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s22s1 | B. | 1s22s22p5 | ||
| C. | 1s22s22p63s2 | D. | 1s22s22p63s23p64s1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2既是氧化剂又是还原剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 3molNa2O2发生反应,有12mol电子转移 | |
| D. | Na2FeO4在水中被氧化得到Fe3+,Fe3+水解生成氢氧化铁,可净水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com