
为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是
A | B | C | D | |
被提纯物质 | 酒精(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
除杂试剂 | 生石灰 | 氢氧化钠溶液 | 酸性高锰酸钾溶液 | KI溶液 |
分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A. 液氨汽化时要吸收大量的热,可用作制冷剂
B. 氯化钠是电解质,可电解其水溶液获得金属钠
C. SO2有还原性,常用来漂白纸浆
D. 四氯化碳密度比水大,可用于萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
【答案】C
【解析】
试题分析:A.醋酸在溶液中存在电离平衡:CH3COOH CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
考点:考查电解质溶液的有关知识。
【题型】选择题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(s) zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
A.C的体积分数降低
B.x+y=z
C.平衡向正反应方向移动
D.x+y<z
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:填空题
(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为______
(2)用一个甲基,一个乙基、一个—C3H7分别取代苯环上的氢原子,所得的三取代物有 种。
(3) 组成的混合物中碳的质量分数为 。
组成的混合物中碳的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
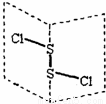
A.S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有S—Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
化学元素家族又添新成员,113号元素Uut和115号元素Uup。已知113号元素的一种核素为 Uut,下列说法中正确的是
Uut,下列说法中正确的是
A. 113号元素的相对原子质量为278
B. 115号元素可显+5价
C.  Uut的中子数与电子数之差为165
Uut的中子数与电子数之差为165
D. 两种元素均位于周期表第八周期
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南琼海嘉积中学高一下期末文科化学试卷(解析版) 题型:填空题
(1)对于反应2S02(g)+O2(g)=2SO3(g),当其他条件不变时,只改变一个反应条件。将生成SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 降低温度 | |
② | 压缩体积 | |
③ | 使用催化剂 |
(2)用铜片、锌片和稀硫酸及若干其他器材组合成一个原电池.如图所示。回答下列问题:
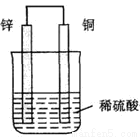
① 该原电池装置将_______(选填“化学能转化为电能”或“电能转化为化学能”);
② 此电池的负极是______,正极的电极反应方程式是________。
③ 该电池工作一段时间,将两个电极小心取出洗涤并晾干,经称量发现锌片比原来减少6.5g(锌的相对原子质量为:65)。请计算理论上导线中共通过了____mol电子。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
一定量的盐酸与过量的铁粉反应时,为了减缓反应速率且不 影响生成氢气
影响生成氢气 的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
的总量,可向盐酸中加入适量的 ①NaOH固体;②Na2SO4溶液;③KNO3溶液;④H2O;⑤CaCO3固体;⑥NaCl固体
A.①②⑤ B.②③⑥ C.②③④⑤ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com