
| A、该合金中nCu:nMg=2:1 |
| B、合金完全溶解时,溶液中C(H+)=8mol/L(忽略反应前后溶液体积变化) |
| C、NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D、得到2.54g沉淀时,加入NaOH溶液的体积是600mL. |
| 1.02g |
| 17g/mol |
| 1.12L |
| 22.4L/mol |
| 1000×1.40×63% |
| 63 |
| 0.64mol |
| 1mol/L |
| 1.02g |
| 17g/mol |
| 0.58mol |
| 0.05L |
| 1.12L |
| 22.4L/mol |
| 0.04mol |
| 0.05mol |
| 1000×1.40×63% |
| 63 |
| 0.64mol |
| 1mol/L |


科目:高中化学 来源: 题型:
| A、进入人体的重金属盐能使蛋白质变性,所以会使人中毒 |
| B、卤代烃C4H8Cl2有四种同分异构体 |
| C、甲烷是天然气的主要成分,能发生加成反应 |
| D、用驴皮熬制成的胶(阿胶)是一种天然橡胶,属于天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
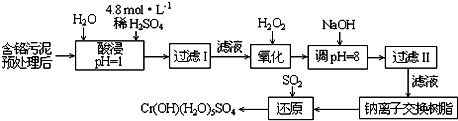
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:
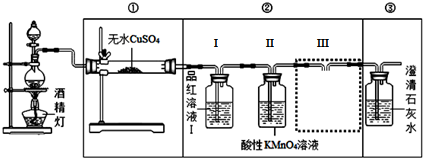
| 实验装置 | ① | ② | ③ |
| 实验现象 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
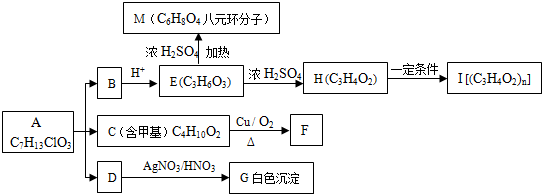
查看答案和解析>>
科目:高中化学 来源: 题型:
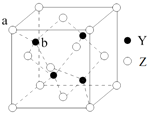 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.查看答案和解析>>
科目:高中化学 来源: 题型:
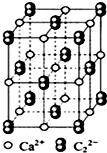 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,体积相等、pH=3的盐酸和醋酸,中和NaOH溶液的能力,盐酸小于醋酸 | ||
B、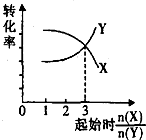 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与率起始时两物质的物质的量之比
| ||
C、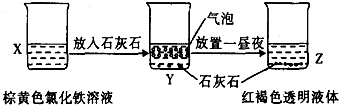 某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3+3CO2↑+3Ca2+ | ||
D、在25℃时,将amo1?L-l的氨水与0.01 moI?L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com