
| A、向CuS04溶液中加入铁时会置换出铜,可推向CuS04溶液中加入钠时也会置换出铜 |
| B、氢氟酸的酸性比盐酸弱,故非金属性是F>Cl |
| C、丁达尔效应是胶体的本质特征 |
| D、MgO可以除去MgCl2溶液中含有的FeCl3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnO4- Cl- NH4+ Na+ |
| B、CO32- NO3- Ca2+Na+ |
| C、SO42- HCO3- K+ Na+ |
| D、SO42-NO3-K+ Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液一定比弱电解质溶液导电能力强 |
| B、不溶性盐是弱电解质 |
| C、强电解质的水溶液中不存在溶质分子 |
| D、因为醋酸是弱电解质,盐酸是强电解质,因此中和等体积等物质的量浓度的醋酸和盐酸时,中和盐酸消耗的氢氧化钠比中和醋酸多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:3 | B、1:2 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
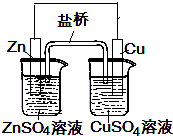
| A、锌是负极,发生氧化反应 |
| B、铜是正极,发生还原反应 |
| C、电流是从Zn流出经导线流入铜电极 |
| D、锌电极质量减少,铜电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com