
【题目】在一定条件下,可逆反应![]() 达到平衡,若:
达到平衡,若:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则![]() ____(填“>”“<”或“=”)p。
____(填“>”“<”或“=”)p。
(2)A、C是气体,而且![]() ,增大压强可使平衡发生移动,则平衡移动的方向是__________。
,增大压强可使平衡发生移动,则平衡移动的方向是__________。
(3)加热后,可使C的质量增加,则正反应是__________(填“放热”或“吸热”)反应。
科目:高中化学 来源: 题型:
【题目】有机物种类繁多,结构复杂。
(1)下列各图均能表示甲烷的分子结构,其中甲烷的球棍模型是__(填序号,下同),表现甲烷的空间真实结构是__。


(2)下列有机物中所有原子可以在同一个平面上的是___(填序号)

(3)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)

①上述有机物中与(c)互为同分异构体的是__(填序号)。
②写出有机物(a)的名称__。
③有机物(a)有一种同分异构体,试写出其结构简式__。
④写出与(c)互为同系物的最简单有机物和溴水反应的化学方程式:__;生成物的名称是___。
(4)某单烯烃与氢气加成后生成异戊烷,该烯烃的结构简式有__种。
(5)“立方烷”是一种新合成的烃,其分子为正方体结构。如图表示立方烷,正方体的每个顶点是一个碳原子,氢原子均省略,一条短线表示一个共用电子对。碳原子上的二个氢原子被氨基(-NH2)取代,同分异构体的数目有_种。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,近年来发现了一种新的星际分子,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,颜色相同的球表示同一种原子)。
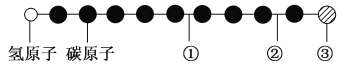
下列对该物质的说法中正确的是
A. ①处的化学键表示碳碳双键 B. ②处的化学键表示碳碳单键
C. ③处的原子可能是氯原子或氟原子 D. 此星际分子属于烃类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中加入4mol A和6mol B,发生如下反应:2A(g)+3B(g)![]() 4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
4C(g)+D(g)反应10min后达平衡,此时D的浓度为0.5mol/L。下列说法正确的是
A. 前10min反应的平均速率V(C)=0.10mol/L·min
B. 反应达平衡时B的平衡浓度是1.5mol/L
C. 恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L
D. 10min后向容器中加入A,保持温度不变重新平衡时A的转化率大于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火箭使用的推进剂燃料由N、H两种元素组成,且原子个数N:H=1:2,其水溶液显碱性,则该物质中N原子的杂化方式为______________________。
(2)笑气(N2O)曾被用作麻醉剂,但过度吸食会导致身体机能紊乱。预测N2O的结构式为________________________。
(3)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
元素 | C1 | Br | I | O | O- |
电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
下列说法正确的是___________。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(4)在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为:2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:
①冰晶石的化学式为____________________________。
②冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是___________(填微粒符号)。
③冰晶石溶液中不存在的微粒间作用力有________________(填选项字母)。
A 离子键 B 共价键 C 配位键 D 金属键 E 范德华力 F 氢键
④Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若已知A1的原子半径为d cm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则晶胞中Al原子的配位数为________;Al晶体的密度为__________g.cm-3(用字母表示)。
(5)配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如图所示。

①Fe(CO)5晶体类型属于__________晶体。
②关于Fe(CO)5,下列说法正确的是_____。
A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1mol Fe(CO)5含有10mol配位键
D.反应Fe(CO)5=Fe+5CO没有新化学键生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向 移动(填“向左”、“向右”或“不”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将向___________移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将___________移动(填“向 左”、“向右”或“不”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是:
A. 铅蓄电池放电时,负极反应式为PbO2+4H++SO![]() +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
B. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=== Cu
C. 生铁中含碳,抗腐蚀能力比纯铁强
D. 铁制品上镀锌,锌做阴极,铁制品做阳极,电解质溶液中含Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一种丰富的资源,工业上可从海水中提取多种物质,广泛应用于生活、生产、科技等方面。如图是某工厂对海水资源进行综合利用的示意图。

回答下列问题:
(1)流程图中操作a的名称为____。
(2)工业上从海水中提取的NaCl,可用来制取纯碱,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是_____(填化学式)
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是____。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是_____。
②操作b是在___氛围中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品“三盐”(3PbO·PbSO4·H2O),主要制备流程如下:

(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为 ____________________________。
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为____________(写化学式)。
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为____________________________;滤液2中溶质主要成分为________(写化学式)。
(4)步骤⑥合成三盐的化学方程式为 _______________________________________。
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤干净的方法是 ___________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com