
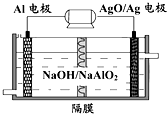
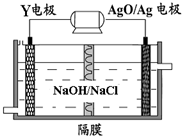
 Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是( )
Al-AgO 电池性能优越,可用作水下动力电源,其原理如图所示.该电池反应的化学方程式为:2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O,则下列说法正确的是( )

科目:高中化学 来源: 题型:
 (2013?河东区一模)短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答:
(2013?河东区一模)短周期元素X、Y、Z、W原子序数依次增大.X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中.请回答: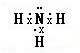
查看答案和解析>>
科目:高中化学 来源: 题型:
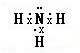
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | AlOH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | AlOH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
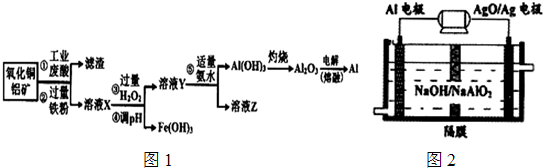
查看答案和解析>>
科目:高中化学 来源:2013年山东省淄博市高考化学一模试卷(解析版) 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | AlOH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
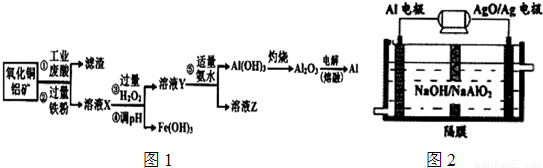
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com