
下列描述正确的是 ( )。
A.CS2为V形极性分子
B.SiF4与SO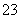 的中心原子均为sp3杂化
的中心原子均为sp3杂化
C.C2H2分子中σ键与π键的数目比为1:1
D.水加热到很高温度都难分解是因水分子间存在氢键
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
用U形管做电解槽,惰性电极电解Na2CO3溶液,阳极和阴极所收集气体的体积比为(气体经干燥,并在同温同压下测量)( )
A.1∶2 B.2∶1 C.略大于1∶2 D.略大于2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6 g,若其中水的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.2 g
C.4.4 g D.在2.2 g和4.4 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是( )
A.反应物总能量低于生成物总能量时,该反应不能发生
B.稀的强酸与稀的强碱反应放出的热量就是中和热
C.由C(石墨,s)===C(金刚石,s) ΔH>0可知石墨比金刚石稳定
D.在101 kPa、25 ℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ的热量;氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===
2H2O(l) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是 ( )。
A.冰融化时,分子中 H—O 键发生断裂
B.原子晶体中,共价键越强,熔点越高
C.分子晶体中,共价键键能越大,该分子晶体的熔、沸点一定越高
D.分子晶体中,分子间作用力越大,该物质越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
下表所列物质晶体的类型全部正确的一组是 ( )。
| 原子晶体 | 离子晶体 | 分子晶体 | |
| A | 氮化硅 | 磷酸 | 单质硫 |
| B | 单晶硅 | 氯化铝 | 白磷 |
| C | 金刚石 | 烧碱 | 冰 |
| D | 铁 | 尿素 | 冰醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子晶体的数据大小比较不正确的是( )。
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①101 kPa时,C(s)+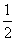 O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH1=-110.5 kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1
下列结论正确的是( )
A.若碳的燃烧热用ΔH3来表示,则ΔH3<ΔH1
B.若碳的燃烧热用ΔH3来表示,则ΔH3>ΔH1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种微粒:
①A微粒核内有14个中子,核外M电子层上有2个电子
②B微粒得到2个电子后,其电子层结构与Ne相同
③C微粒带有一个单位的正电荷,核电荷数为11
④D微粒核外有18个电子,当失去1个电子时呈电中性
⑤E微粒不带电,其质量数为1
依次写出A、B、C、D、E各微粒的符号:________、
________、________、________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com