
(16分)对二甲苯(英文名称p-xylene,缩写为PX)是一种低毒化合物,也是聚酯工业的重要原料,主要用于生产对苯二甲酸(PTA),对苯二甲酸再和乙二醇(EG)反应生成聚对苯二甲酸乙二醇酯(PET)。国内对二甲苯产量增长步伐放缓,供应缺口加大,近一半的PX依靠进口。以PX为主要原料生产PET的一种路线如下:

(1)PX可以发生的反应类型有加成反应、 、 。(填反应类型)
(2)PX的核磁共振氢谱有 组峰,峰面积之比为 。
(3)反应②的化学方程式为 。(不用注明条件)
(4)PX的来源之一是煤的干馏。已知煤干馏副产物煤焦油主要成分有苯、甲苯、混合二甲苯、酚类等,从煤焦油中分离提纯对二甲苯的方法是 。
(5)“甲苯甲醇烷基化”制备对二甲苯是一条增产PX的新工艺路线:
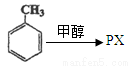
写出该反应的化学方程式: 。(不用注明条件)
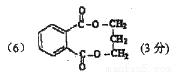
(6)PTA的一种同分异构体X与其含有相同官能团,且其苯环上的一氯取代物有两种,写出化合物X与1,3-丙二醇形成最简单环酯的结构简式: 。
(1)取代反应,氧化反应 (4分)
(2)2 (1分) 6:4或4:6或3:2或2:3(1分)
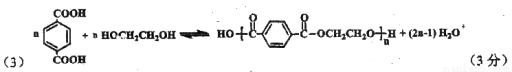
(4)蒸馏(2分)
【解析】
试题分析:(1)对二甲苯属苯的同系物,具有苯的同系物的性质。
(2)对二甲苯苯环上的四个氢原子等效,而甲基上的六个氢原子等效,所以峰面重叠则为6:4。
(3)缩合聚合反应,注意参照课本书写方法。
(4)分离相溶的混合物,采用蒸馏或分馏的方法。
(5)可以先根据题意写出反应物和PX,最后用原子守恒的方法写出小分子。
(6)根据含有相同的官能团,且一氯代物有两种,可知是邻苯二甲酸。
考点:苯的同系物的性质;有机化合物等效氢原子;核磁共振氢谱;缩合聚合反应;分离和提纯的方法;有机化学方程式的书写 ;同分异构等。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:2013-2014广东省惠州市高一下学期期末考试化学(理)试卷(解析版) 题型:选择题
为了使AlCl3溶液中的Al3+离子尽可能全部转化为Al(OH)3沉淀,最合适的试剂是
A.NaOH溶液 B.KOH溶液 C.盐酸 D.氨水
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省广州市越秀区高二下学期期末水平调研化学试卷(解析版) 题型:选择题
下列有关实验的说法正确的是
A.在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度
B.检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加入AgNO3溶液进行检验
C.为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法
D.用纸层析法分离Cu2+和Fe3+,滤纸上端呈棕黄色,说明Fe3+在固定相中分配的更多
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:填空题
(16分)邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一:
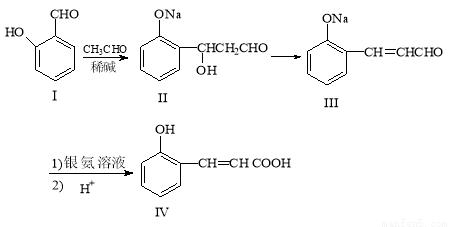
试回答下列问题:
(1)化合物Ⅰ的名称是 ;化合物II→化合物III 的有机反应类型: ;
(2)化合物III 在银氨溶液中发生反应化学方程式: ;
(3)有机物 X 为化合物IV的同分异构体,且知有机物X 有如下特点:
①苯环上的氢有两种,②能与NaHCO3 反应放出气体,③能发生银镜反应。
请写出两种化合物X的结构简式_____________________、___________________________
(4)下列说法正确的是 ;
A.化合物I遇氯化铁溶液呈紫色
B.化合物II能与NaHCO3溶液反应
C.1mol化合物IV完全燃烧消耗 9.5molO2
D.1mol化合物III最多能与3 molH2 反应
(5)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则 R 在NaOH 醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
能在透明溶液中大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Cu2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高三5月综合测试理综化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞试液显红色的溶液中:K+、Na+、Cu2+、SO42—
B.在c(H+)/c(OH—)=10—12的溶液中:K+、Ba2+、Cl—、ClO—
C.水电离产生的c(H+)=10—13mol?L—1 的溶液中:Na+、Cl—、NO3—、CH3COO—
D.pH=0的溶液中:Na+、NO3—、S2—、Cl—
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省佛山市高三教学质量检测二理综化学试卷(解析版) 题型:推断题
(16分)乌尔曼反应是偶联反应的一种,可以实现卤代苯与含氮杂环的反应。例如:
反应①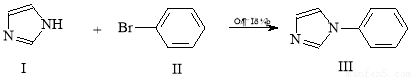
(1)化合物Ⅰ的分子式为_________________________。
(2)化合物Ⅳ是化合物Ⅱ的同系物,分子式为C8H9Br,Ⅳ为苯的对位二取代物,其核磁共振氢谱图共有4组峰,峰面积比为2:2:2:3,其结构简式为_____________(任写一种)。
(3)1mol化合物Ⅲ可以与____molH2发生加成反应,产物结构简式为______________。
(4)化合物Ⅳ的一种同分异构体Ⅴ的结构简式为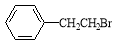 ,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:___________________________________________。
,Ⅴ与氢氧化钠醇溶液加热条件下反应的方程式为:___________________________________________。
(5)一定条件下,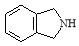 与
与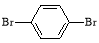 也可以发生类似反应①的反应,参加反应的分子数为2:1,则生成的产物的结构简式为_________________。
也可以发生类似反应①的反应,参加反应的分子数为2:1,则生成的产物的结构简式为_________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014广东省高二下学期期中化学试卷(解析版) 题型:选择题
下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)
A.溴乙烷B.乙醇
C.橄榄油D.苯乙烯
查看答案和解析>>
科目:高中化学 来源:2013-2014广东清远市市高一下学期期末考试化学试卷(解析版) 题型:填空题
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下:
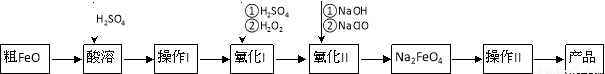
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
① Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
请描述随温度变化规律:温度小于30℃时,NaClO浓度随温度升高而增大;温度高于30℃时,____________________________________________________。NaClO浓度随温度变化具有上述规律的原因为:________________________________________________________
_______________________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com