
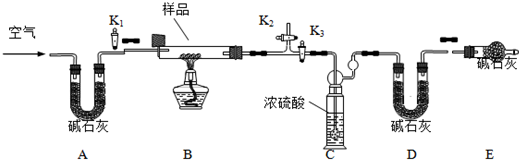
 (1)实验室中制取少量干燥纯净的气体A,可用如图装置.
(1)实验室中制取少量干燥纯净的气体A,可用如图装置.

科目:高中化学 来源: 题型:阅读理解
| 编号 | V (Na2CO3)/mL | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 |
| 3 | 2.0 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 |
| 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 40 | 多、蓝色 |
| 2 | 60 | 少、浅绿色 |
| 3 | 75 | 较多、绿色 |
| 4 | 80 | 较多、绿色(少量褐色) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
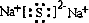
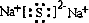
查看答案和解析>>
科目:高中化学 来源: 题型:
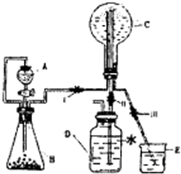
(1)A的名称________________________________。
(2)写出B→C的化学方程式________________________________。
(3)检验B或D可选用同一种试剂,且加热反应后都有红色沉淀生成,写出D与这种试剂反应的化学方程式________________________________________________。
(4)写出所有比G少一个碳原子的G的同系物的结构简式___________________。
(5)反应①、②、③中,与反应④类型相同的是________________(填序号)。
(6)写出实验室中制取G后,提纯并分离G的操作方法________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
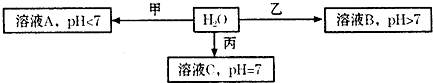
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com