
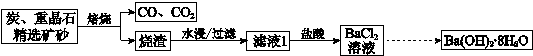
| 10℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| Ba(OH)2?8H2O | 2.48 | 3.89 | 8.22 | 20.9 | 101 |
| NaOH | 98.0 | 109 | 129 | 174 | 314 |
| NaCl | 35.8 | 35.9 | 36.4 | 37.1 | 38.0 |
| BaCl2 | 33.5 | 35.8 | 40.8 | 46.2 | 52.5 |

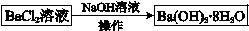


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 污渍爆炸盐 | 漂白粉 |
| 产品样式 |  |  |  |  |  |
| 有效成分 或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过碳酸钠 | 消毒 |

| 实验步骤 | 实验现象 | 实验结论 |
| 把少量漂白粉样品加入水中,通入足量的CO2气体, | 漂白粉的漂白作用已完全失效. |
查看答案和解析>>
科目:高中化学 来源: 题型:
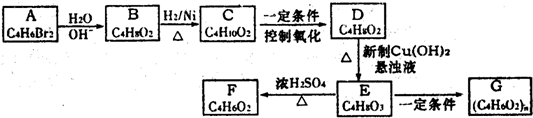
查看答案和解析>>
科目:高中化学 来源: 题型:
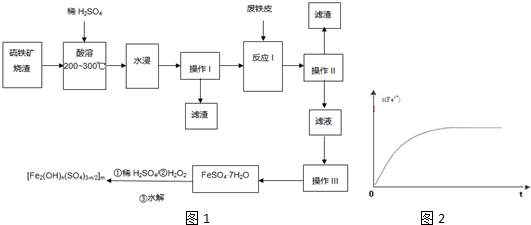
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20% | B、25% |
| C、80% | D、85% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | ||
B、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| C、浓度均为0.1mol?L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] | ||
| D、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,存在a+b=14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com