
某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是_____________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为________________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为____________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是________________,生成沉淀的原因是________________(用平衡移动原理解释)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届辽宁省六校协作体高三上学期期中化学试卷(解析版) 题型:选择题
下列各组离子在酸性溶液中能大量共存的是
A、Na+、Fe2+、NO3-、SCN— B、Ca2+、K+、Cl—、NO3—
C、Al3+、K+、OH—、NO3— D、Na+、Ca2+、S iO32—、Cl—
iO32—、Cl—
查看答案和解析>>
科目:高中化学 来源:2017届天津市高三上质量调查二化学卷(解析版) 题型:选择题
下列除去杂质的方法正确的是( )
A.除去CO2中混有的SO2:用氢氧化钠溶液洗气
B.除去Cl2中混有的HCl:用饱和食盐水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铜粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
查看答案和解析>>
科目:高中化学 来源:2017届四川省资阳市高三上第一次诊断化学试卷(解析版) 题型:填空题
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)请配平以下化学方程式:
_______Al+_______NaNO3+_______NaOH=_______NaAlO2+_______N2↑+_______H2O
若反应过程中转移5 mol电子,则生成标准状况下N2的体积为___________L。
(2)25℃时,将a mol·L-1的氨水与0.1mol·L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为_____________。
a.盐酸不足,氨水剩余 b.氨水与盐酸恰好完全反应 c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
HSO3-的电离平衡常数表达式K=_________。
0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源:2017届四川省资阳市高三上第一次诊断化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列与NA有关的说法正确的是( )
A.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,当得到标准状况下67.2 L Cl2时,反应中转移的电子数为6 NA
B.6.0 g SiO2晶体中含有的硅氧键数目为0.2 NA
C.标准状况下,22.4 L NO和11.2 L O2混合后气体的分子总数为NA
D.S2和S8的混合物共6.4 g,其中所含硫原子数一定为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2017届四川省泸州市高三上10月月考化学卷(解析版) 题型:选择题
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A.1.0L1.0mol·L-1的NaAlO2水溶液中含有氧原子数为2NA
B.16 g O3和O2混合物中氧原子数为NA
C.25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.1mol的羟基与1mol的氢氧根离子所含的电子数均为9NA
查看答案和解析>>
科目:高中化学 来源:2017届山西省大同市高三上学期第一次调研化学试卷(解析版) 题型:选择题
将17.9g由Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生气体3.36L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,向反应后的溶液中加入过量的NaOH溶液,得到的沉淀的质量为25.4g。若硝酸的还原产物仅为NO,则生成的NO在标准状况下的体积为( )
A.2.24L B.4.48L C.6.72L D.8.96L
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上学期10月质检化学试卷(解析版) 题型:选择题
在25 ℃时,将a g NH3完全溶于水,得到V mL pH=8的氨水,假设该氨水的密度为ρ g·cm-3,溶质的质量分数为ω,其中含NH4+的物质的量为b mol,下列叙述中错误的是( )
A.溶质的质量分数为ω=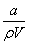 ×100%
×100%
B.溶质的物质的量浓度c=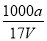 mol·L-1
mol·L-1
C.溶液中c(OH-)=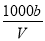 mol·L-1
mol·L-1
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com