

| A����С��Ӧ������� | B��ͨ��CO2 |
| C�������¶ȵ�900�� | D��ʹ�ú��ʵĴ��� |
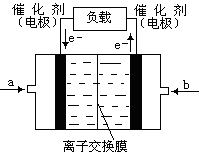
 �����x��0.5����ת������50��������CO��Ũ����4mol��0.5��2L��1mol/L�����Է�Ӧ������1mol/L��10min��0.1mol/(L��min��1)��
�����x��0.5����ת������50��������CO��Ũ����4mol��0.5��2L��1mol/L�����Է�Ӧ������1mol/L��10min��0.1mol/(L��min��1)��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
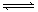 cC(g)+dD(g)��ƽ������¶Ȳ��䣬���������ѹ����ԭ����һ�롣���ﵽ�µ�ƽ��ʱ��D��Ũ��Ϊԭƽ��ʱ��1.6������
cC(g)+dD(g)��ƽ������¶Ȳ��䣬���������ѹ����ԭ����һ�롣���ﵽ�µ�ƽ��ʱ��D��Ũ��Ϊԭƽ��ʱ��1.6������| A��ƽ��������Ӧ�����ƶ� | B�� A��ת���ʱ�С |
| C��D���������� | D��a>c+d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)�ﵽƽ��״̬�ı�־�ǣ� ��
2C(g)�ﵽƽ��״̬�ı�־�ǣ� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z(g)��X2��Y2��Z��ʼŨ�ȷֱ�Ϊ 0.2mol?L��1 �� 0.6mol?L��1��0.4mol?L��1����ƽ��ʱ���������ݿ϶����Ե���
2Z(g)��X2��Y2��Z��ʼŨ�ȷֱ�Ϊ 0.2mol?L��1 �� 0.6mol?L��1��0.4mol?L��1����ƽ��ʱ���������ݿ϶����Ե���| A��X2Ϊ0.4mol?L��1��Y2Ϊ1.2mol?L��1���� | B��Y2Ϊ1.0mol?L��1 |
| C��X2Ϊ0.3mol?L��1��ZΪ0.2mol?L��1 ���� | D��ZΪ0.6mol?L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g)����֪H2��I2����ʼŨ�Ⱦ�Ϊ0.10 mol/L���ﵽƽ��ʱHI��Ũ��Ϊ0.16 mol/L����H2��I2����ʼŨ�Ⱦ�Ϊ0.20 mol/L����ƽ��ʱH2��Ũ��(mol/L)��
2HI(g)����֪H2��I2����ʼŨ�Ⱦ�Ϊ0.10 mol/L���ﵽƽ��ʱHI��Ũ��Ϊ0.16 mol/L����H2��I2����ʼŨ�Ⱦ�Ϊ0.20 mol/L����ƽ��ʱH2��Ũ��(mol/L)��| A��0.32 | B��0.16�� | C��0.08 | D��0.04 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
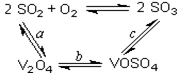
 SO3+ V2O4
SO3+ V2O4  2V2O5+4SO3��
2V2O5+4SO3��| ѹǿ/MPa �¶�/�� | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

 2SO2+O2 ��550 ��ʱ��ƽ�ⳣ��K= ��
2SO2+O2 ��550 ��ʱ��ƽ�ⳣ��K= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
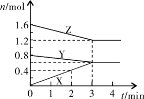
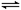 xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1�������ж���ȷ����
xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1�������ж���ȷ����| A��A��ת����Ϊ40% |
| B��2 min��B�ķ�Ӧ����Ϊ0.2 mol��(L��min)��1 |
| C��x��2 |
| D�������������ܶȲ��䣬������÷�Ӧ�Ѵﵽƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H��+HA����HA��
H��+HA����HA�� H��+A2����
H��+A2���� Ca2��(aq)+A2��(aq) ��H��0��
Ca2��(aq)+A2��(aq) ��H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com