
| 电解 |

| 0.7xg |
| 87g/mol |
| 0.8yg |
| 97g/mol |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
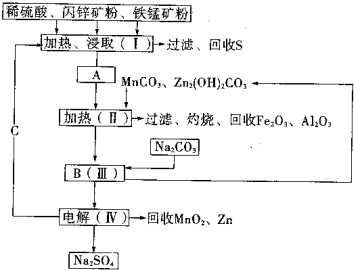 (2011?湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
(2011?湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| 电解 |
查看答案和解析>>
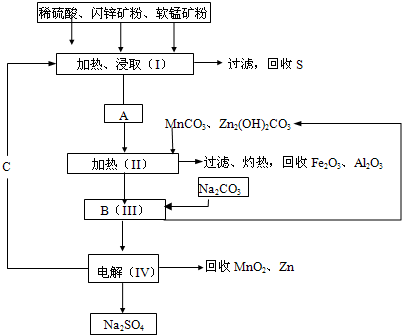
科目:高中化学 来源:2013-2014学年云南省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是 。
(2)加入MnCO3、Zn2(OH)2CO3的作用是 :C的化学式是 。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是 。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式 。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、 、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是 。
查看答案和解析>>
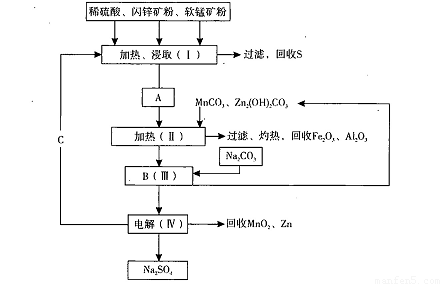
科目:高中化学 来源:2013-2014学年辽宁省抚顺市六校联合体高三上学期期中考试化学试卷(解析版) 题型:填空题
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):
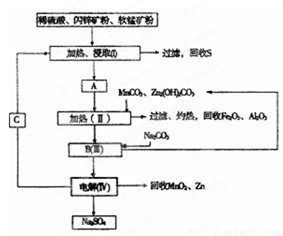
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解方程式为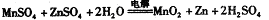
(1)A中属于还原产物的是_____。
(2)加人MnCO3、Zn2(OH)2CO3的作用是_________________;II需要加热的原因是:______ ;C的化学式是_________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_____。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工 原料是_______。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进 行的操作有蒸发浓缩、 、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省襄阳市高三12月统一测试理综化学试卷(解析版) 题型:填空题
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS),共同生产MnO2和Zn(干电池原料)。
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O  MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。

(1)A中属于还原产物的是 。
(2)MnCO3、Zn2(OH)2CO3的作用是 ;Ⅱ需要加热的原因是 ;C的化学式是 。
(3)Ⅲ中发生的离子方程式为 , ;
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com