
·ÖĪö £Ø1£©CaCO3Ī¢Į£²»ČÜÓŚĖ®£»
£Ø2£©Ąė×ÓæÉĶø¹ż°ėĶøĤ£¬¶ų½ŗĢå²»ÄÜ£»
£Ø3£©ŅŅ“¼ÓėŹ³ŃĪµÄ·Šµć²»Ķ¬£»
£Ø4£©Ģ¼ĖįøĘøßĪĀ·Ö½āÉś³ÉCaO£®
½ā“š ½ā£ŗ£Ø1£©CaCO3Ī¢Į£²»ČÜÓŚĖ®£¬Ōņ¹żĀĖ³żČ„Ca£ØOH£©2ČÜŅŗÖŠŠüø”µÄCaCO3Ī¢Į££¬¹Ź“š°øĪŖ£ŗ¹żĀĖ£»
£Ø2£©Ąė×ÓæÉĶø¹ż°ėĶøĤ£¬¶ų½ŗĢå²»ÄÜ£¬ŌņÓĆÉųĪöµÄ·½·Ø³żČ„Fe£ØOH£©3½ŗĢåÖŠ»ģÓŠµÄŌÓÖŹCl-Ąė×Ó£¬¹Ź“š°øĪŖ£ŗÉųĪö£»
£Ø3£©ŅŅ“¼ÓėŹ³ŃĪµÄ·Šµć²»Ķ¬£¬Ōņ³żČ„ŅŅ“¼ÖŠČܽāµÄĪ¢ĮæŹ³ŃĪæɲÉÓĆÕōĮó·Ø£¬¹Ź“š°øĪŖ£ŗÕōĮó£»
£Ø4£©Ģ¼ĖįøĘøßĪĀ·Ö½āÉś³ÉCaO£¬ŌņĄūÓĆ¼ÓČČ·Ö½ā·Ø³żČ„Ńõ»ÆøĘÖŠµÄĢ¼ĖįøĘ£¬¹Ź“š°øĪŖ£ŗ¼ÓČČ·Ö½ā£®
µćĘĄ ±¾Ģāæ¼²éĪļÖŹµÄ·ÖĄė”¢Ģį“棬²ąÖŲӌѧɜµÄ·ÖĪöÄÜĮ¦ŗĶŹµŃéÄÜĮ¦µÄ漲飬ĪŖøßĘµæ¼µć£¬×¢Ņā°ŃĪÕĪļÖŹµÄŠŌÖŹµÄŅģĶ¬ĪŖ½ā“šøĆĢāµÄ¹Ų¼ü£¬ĢāÄæÄŃ¶Č²»“ó£®


 ŠĀæĪ±źĶ¬²½ŃµĮ·ĻµĮŠ“š°ø
ŠĀæĪ±źĶ¬²½ŃµĮ·ĻµĮŠ“š°ø Ņ»ĻßĆūŹ¦æŚĖćÓ¦ÓĆĢāĢģĢģĮ·Ņ»±¾Č«ĻµĮŠ“š°ø
Ņ»ĻßĆūŹ¦æŚĖćÓ¦ÓĆĢāĢģĢģĮ·Ņ»±¾Č«ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
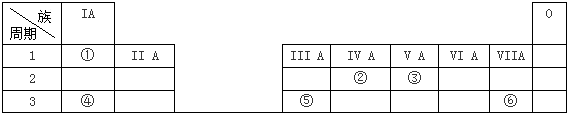
| ×å ÖÜĘŚ | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| ¶ž | ¢Ł | ¢Ś | ||||||
| Čż | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | ¢į | |
| ĖÄ | ¢ā | ⑪ | ⑫ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ģ¼ĖįĒāøĘČÜŅŗÖŠ¼ÓČė¹żĮæµÄĒāŃõ»ÆÄĘČÜŅŗHCO3-+OH-ØTCO32-+H2O | |
| B£® | ĀČ»ÆĢśČÜŅŗÖŠĶØČėĮņ»ÆĒāĘųĢå2Fe3++S2-ØT2Fe2++S”ż | |
| C£® | “ĪĀČĖįøĘČÜŅŗÖŠĶØČė¹żĮ涞Ńõ»ÆĢ¼Ca++2ClO-+H2O+CO2ØTCaCO3”ż+2HClO | |
| D£® | FeCl3ČÜŅŗÖŠ¼ÓČėÉŁĮæµÄHIČÜŅŗ£ŗ2Fe3++2I-ØT2Fe2++I2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ū¹āŅ×·Ö½āµÄAgBr³£ÓĆ×öøŠ¹ā²ÄĮĻ | B£® | ÅØĻõĖįæÉæĢŹ“ŹÆÓ¢ÖĘŅÕŹõĘ· | ||
| C£® | 84Ļū¶¾ŅŗµÄÓŠŠ§³É·ÖŹĒNaClO | D£® | ÅØ°±Ė®æɼģŃéĀČĘų¹ÜµĄŠ¹Ā© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CuCl2+2NaOHØTCu£ØOH£©2”ż+2NaCl | B£® | CO+CuO$\frac{\underline{\;\;”÷\;\;}}{\;}$CO2+Cu | ||
| C£® | Mg+2HClØTMgCl2+H2”ü | D£® | Cl2+H2OØTHCl+HClO |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com