
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
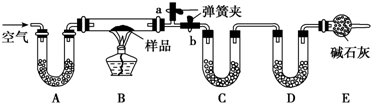
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的(已知,气压减小,水的沸点降低)( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的(已知,气压减小,水的沸点降低)( )| A、氢氧化钠溶液、二氧化碳 |
| B、盐酸、氨气 |
| C、氢氧化钠溶液、一氧化碳 |
| D、石灰水、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | IA | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)①如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为
(1)①如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )下列关于苧烯的说法中,正确的是( )
)下列关于苧烯的说法中,正确的是( )| A、分子式为C10H16,是1,3-丁二烯的同系物 |
| B、其分子内所有的碳原子均在同一平面上 |
| C、易溶于水,能发生加聚反应生成高分子化合物 |
D、与过量的Br2的CCl4 溶液反应的产物为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com