
下列有关物质性质及对应用途的说法正确的是( )
A.利用浓硫酸的脱水性,干燥氢气
B.氧化镁熔点高,可用于制造耐火 材料
材料
C.碳酸钠溶液呈碱性,可用于治疗胃酸过多
D.二氧化硫有漂白性,故可使酸性高锰酸钾溶液褪色
科目:高中化学 来源:2017届内蒙古高三上月考四化学卷(解析版) 题型:填空题
Ⅰ. 工业上可通过CO和H2化合制得CH3OH: CO(g)+2H2(g)  CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
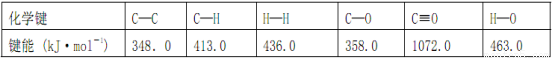
则ΔH =_____________,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,则放出或吸收的热量Q ________ ΔH 的数值(填“>”、“=”或“<”)。
Ⅱ.电化学降解NO3-的原理如右图所示。
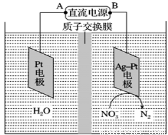
①电源 A 极为________(填“正极”或“负极”),阴极反 应式为_______________。
应式为_______________。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________g。
Ⅲ.已知NO2和N2O4的相互转化反应:2NO2(g) N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
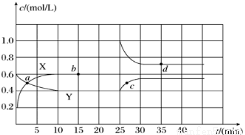

①图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间 变化而改变
变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
②前 10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min) 。
。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________(用文字表达);其平衡常数 K(d)________K(b)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:选择题
下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合: 2AlO |
|
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:实验题
钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
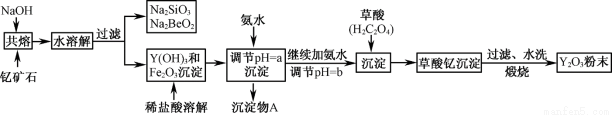
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | |
Fe3+ | 2.7 | 3.7 | |
Y3+ | 6.0 | 8.2 | |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。请回答下列问题:
(1)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和 两种试剂,再通过必要的操作即可实现。
A.NaOH溶液  B.氨水 C.CO2 D.HNO3
B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式 。
(2)为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在 范围内;继续加氨水调节pH =b发生反应的离子方程式为 ;检验Fe3+是否沉淀完全的操作方法是 。
(3)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3.nH2O]煅烧的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期期中化学卷(解析版) 题型:选择题
右表为元素周期表短周期的一部分。下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
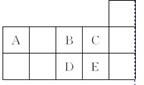
A. D单质在过量的B单质中燃烧的主要产物为DB3
B. C的氢化物的水溶液酸性比E的强
C. 工业上常将E单质通入澄清石灰水中制漂白粉
D. A与B形成的阴离子可能有AB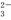 、A2B
、A2B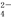
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:实验题
(1)有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
①这种错误操作 (填“一定”/“一定不”/“不一定”)会导致实验结果有误差。
②若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 。
(2)、用已知浓度的 NaOH 溶液测定某 HCl溶液的浓度,参考右图,从表中选出正确序号
序号 | 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 |
|
A | 碱 | 酸 | 石 | (乙) |
B | 酸 | 碱 | 酚酞 | (甲) |
C | 碱 | 酸 | 甲基橙 | (甲) |
D | 酸 | 碱 | 酚酞 | (乙) |
(3)、用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是 。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:选择题
反应CO(g)+H2O(g)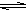 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市四校高一期中联考化学试卷(解析版) 题型:实验题
现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂除去溶液中的NaCl和Na2SO4,从而得到纯净的NaNO3溶液。相应的实验过程可用下图表示: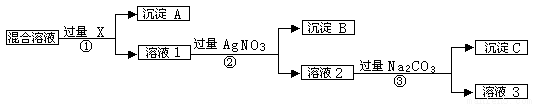 请回答下列问题:
请回答下列问题:
⑴写出实验流程中下列物质的化学式 试剂X__________,沉淀A___________,沉淀B__________。
⑵上述实验流程中加入过量的Na2CO3的目的是 。
⑶按此实验方案得到的溶液3中肯定含有__________(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的___________,如果要获得固体NaNO3需进行的实验操作是___________(填操作名称)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林两省八校高一上学期期中化学试卷(解析版) 题型:选择题
下列基本反应类型中,一定是氧化还原反应的是( )
A.复分解反应 B.置换反应 C.分解反应 D.化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com