
【题目】观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,用化学用语回答下列有关问题。

(1)其中属于阴离子的是_____;
(2)其中化学性质最稳定的是_____;
(3)已知A元素的某种核素的中子数为18,该核素的符号是_____;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该元素的离子结构示意图为_____。
【答案】O2 Ne 35Cl 
【解析】
(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B. C. D.E分别是Cl、O2、Ne、Na、Mg2+,则属于阴离子的是O2;
(2)最外层电子达到稳定结构时该微粒性质最稳定,所以性质最稳定的是Ne;
(3)已知A元素的某种核素的中子数为18,质子数为17,质量数=质子数+中子数=18+17=35,该核素的符号是35Cl;
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子为6个,则核电荷数为16,为硫元素,该元素的离子为得到两个电子的阴离子,该元素的离子结构示意图为: 。
。


科目:高中化学 来源: 题型:
【题目】“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳、硫及其化合物的综合利用 成为研究的热点。
(1)下列事实中,能用来比较碳元素和硫元素的非金属性强弱的是____________(填字母)。
A.SO2具有漂白性而CO2没有
B.少量H2SO3可与Na2C03反应生成NaHCO3
C.SO2能使酸性KMnO4溶液褪色而CO2不能
D.Na2CO3溶液显碱性,而Na2SO4溶液显中性
(2)通过热循环进行能源综合利用的反应系统的原理如下图所示。

系统(Ⅱ)制取氢气的热化学方程式为________________________;
两个系统制得等量的H2时所需能量较少的是________________________。
(3)向10L恒容密闭容器中充入2 molCO和1molSO2,发生反应2CO(g)+SO2(g)![]() S(g)+2CO2(g)。CO和CO2的平衡体积分数(
S(g)+2CO2(g)。CO和CO2的平衡体积分数(![]() )与温度(T)的变化关系如下图所示。
)与温度(T)的变化关系如下图所示。

①图中表示CO的平衡体积分数与温度的变化关系的曲线为_____________(填“L1”或“L2”)。
②T1℃时,SO2的平衡转化率a1=_____________,反应的平衡常数K1=_____________。
③只改变下列条件,既能加快该反应的反应速率,又能增大CO的平衡转化率的是_____________(填字母)。
A.增大压強
B.充入一定量的H2S
C.充入一定量的SO2
D.加入适当催化剂
④向起始溢度为T1℃的10L绝热容器中充入2molCO和1molSO2,重复实验,该反应的平衡常数K2___(填“>”“<”或“=”)K1,理由为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率![]() ×100%,下列说法不正确的是
×100%,下列说法不正确的是
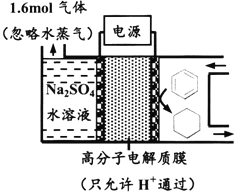
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若![]() =75%,则参加反应的苯为0.8mol
=75%,则参加反应的苯为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池是以表面涂有钌(Rii)基配合物的TiO2光敏染料的透明导电玻璃和镀Pt导电玻璃为极板。其工作原理如下图所示:

下列关于该电池叙述正确的是
A. 电池工作时电能由光能直接转化而来,不涉及化学能转化
B. 电池工作的总反应为:RuII+I3-=RuIII+3I-
C. 当太阳光照射光敏染料时,光敏染料所在电极的电势低于镀Pt导电玻璃电极
D. 电池工作时,为持续供电,需要定期补充有关电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂离子蓄电池是第二代锂离子动力电池。一种以软锰矿浆(主要成分为MnO2,含少量 Fe2O3、FeO、A12O3、SiO2等杂质)为原料制备锰酸锂的流程如下图所示。

(1)溶浸生产中为提高SO2回收率可采取的措施有_________(填序号)
a.不断搅拌,使SO2和软锰矿浆充分接触
b.增大通入SO2的流速
c.减少软锰矿浆的进入量
d.减小通入SO2的流速
(2)已知:室温下,Ksp[A1(OH)3]=1×10-33,Ksp[Fe(OH)3]=l×10-39, pH=7.1 时 Mn(OH)2开始沉淀。氧化除杂时(室温)除去MnSO4液中的Fe3+、Al3+(使其浓度小于1× l0-6mol /L),需调节溶液pH范围为_______。
(3)由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)。请写出发生反应的离子方程式___________。
(4)将MnO2和 Li2CO3按4:1的物质的量比配料,混合搅拌,然后升温至600℃750℃,制取产品LiMn2O4。写出该反应的化学方程式 _____________ 。
(5)锰酸锂可充电电池的总反应为:Li1-xMn2O4+LixC![]() LiMn2O4+C(0<x<1)
LiMn2O4+C(0<x<1)

①充电时,电池的阳极反应式为_________,若此时转移lmole-,则石墨电极将增重______g。
②废旧锰酸锂电池可能残留有单质锂,拆解不当易爆炸、着火,为了安全,对拆解环境的要求是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将100mL某盐酸和硫酸的混合溶液分成两等份。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
(1)每份溶液中所含H2SO4的物质的量______________mol。
(2)原混合溶液中盐酸的物质的量浓度_____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g) ②2M(g)
2Z(g) ②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

反应开始 平衡(I) 平衡(II)
下列判断正确的是
A. 达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11
B. 反应①的正反应是吸热反应
C. 在平衡(I)和平衡(II)中,M的体积分数相等
D. 达平衡(I)时,X的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol H2和1mol I2置于恒温恒容密闭容器中发生反应:H2(g)+I2(g)![]() 2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
|
|
|
|
A | B | C | D |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com