
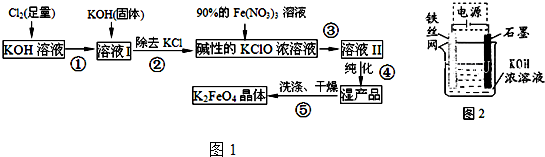
分析 氢氧化钾溶液中充入足量氯气,在温度较低的条件下反应生成氯化钾、次氯酸钾和水,加入氢氧化钾固体除去KCl,得到碱性KClO的浓溶液,加入90%硝酸铁溶液发生反应生成高铁酸钾溶液Ⅱ纯化得到湿产品,洗涤干燥得到K2FeO4晶体;
(1)根据n=$\frac{m}{M}$计算出氢氧化钾的物质的量,溶液质量等于溶质质量与溶剂质量之和,利用V=$\frac{m}{ρ}$计算溶液体积,再根据c=$\frac{n}{V}$计算氢氧化钾溶液的物质的量浓度;
(2)根据生产工艺流程图,第①步氯气过量,第③步需要碱性条件,在温度较高时KOH 与Cl2 反应生成的是KClO3,氧化还原反应中化合价有升有降;
(3)反应③是次氯酸根离子在碱溶液中氧化铁离子为高铁酸根离子,根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)向高铁酸钾溶液中滴加稀硫酸,溶液变黄色,说明生成Fe3+,并产生大量气泡,应为氧气,说明高铁酸钾在酸性条件下自身发生氧化还原反应,生成铁离子、氧气和水;
(5)阳极发生氧化反应,碱性条件下铁被氧化生成FeO42-.
解答 解:(1)61.6g KOH固体的物质的量为$\frac{61.6g}{56g/mol}$=1.1mol,溶液的质量为100mL×1g/mL+61.6g=161.6g,所以溶液的体积为$\frac{161.6g}{1.47×1{0}^{-3}g/L}$=$\frac{161.6}{1470}$L,所以氢氧化钾溶液的物质的量浓度为$\frac{1.1mol}{\frac{161.6}{1470}L}$=10mol/L,
故答案为:10;
(2)由工艺流程可知,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应,生成更多的KClO.
A、与过量的Cl2继续反应,生成更多的KClO,故A正确;
B、由信息②可知温度较高KOH与Cl2 反应生成的是KClO3,不利用KClO生成、浪费原料,故B错误;
C、由工艺流程及③可知,利用Fe(NO3)3与KClO制备K2FeO4,故C正确;
D、由信息可知,该条件下KClO3 不能转化为KClO,故D错误.
故选:AC;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,可得③中反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
每制得59.4克K2FeO4,物质的量=$\frac{59.4g}{198g/mol}$=0.3mol,理论上消耗氧化剂为KClO的物质的量 依据离子方程式定量关系计算,
2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
3 2
n 0.3mol
n=0.45mol
故答案为:0.45;2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)向高铁酸钾溶液中滴加稀硫酸,溶液变黄色,说明生成Fe3+,并产生大量气泡,应为氧气,反应的离子方程式为4FeO42-+20 H+=4Fe3++3O2↑+10H2O,说明高铁酸钾在酸性条件下自身发生氧化还原反应,
故答案为:4FeO42-+20 H+=4Fe3++3O2↑+10H2O;
(5)阳极发生氧化反应,碱性条件下铁被氧化生成FeO42-,电极方程式为Fe+8OH--6e-═FeO42-+4H2O,故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题结合高铁酸钾(K2FeO4)的制备主要考查了氧化还原反应的知识、离子的检验等,为高考常见题型,题目培养了学生运用知识的能力.侧重考查物质制备与物质分离提纯的分析判断,实验过程的理解应用和基本操作的分析应用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

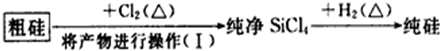
| 物质 | Si | SiCl4 |
| 沸点/℃ | 2355 | 57.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
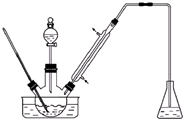 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
 某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.
某同学用0.1082mol/L的NaOH溶液滴定未知浓度的盐酸.| 实验序号 | 待测盐酸溶液体积(mL) | 滴定管读数 | 消耗标准NaOH溶液的体积(mL) | |
| 初读数 | 末读数 | |||
| 1 | 20.00 | 0.00 | 19.90 | 19.90 |
| 2 | 20.00 | 0.05 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 56g铁粉在1mol氯气中充分燃烧,失去的电子数为3NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com