
【题目】为解决能源危机,有人提出用CaCO3制取C2H2作燃料。具体反应为:
① CaCO3(s)![]() CaO(s)+CO2(g)
CaO(s)+CO2(g)
② CaO(s)+3C(s)![]() CaC2(s)+CO(g)
CaC2(s)+CO(g)
③ CaC2(s)+H2O(l)![]() CaO(s)+C2H2(g)
CaO(s)+C2H2(g)
(1)制备1mol C2H2(g)需一定量的C(s),这些炭完全燃烧可放热__________kJ
(2)若1mol C2H2完全燃烧可放出热量1298kJ,则将C2H2(g)作为燃料是否合算?说明理由__________。
(3)为什么反应①和②需要高温,反应③只需常温__________(已知有关物质的△Hf(298k)/kJ·mol-1为:CaC2(s):—60,CO2(g):—393,H2O(l):—285,C2H2(g):227,CaO(s):—635,CaCO3(s):—1207,CO(g):—111)
【答案】1179 kJ 虽然燃烧1mol C2H2(g)放热多于燃烧3 mol C(s)。但反应△rH(298K,①)=+179 kJ/mol,△rH(298K,②)=+464kJ/mol,△rH(298K,③)=-63kJ/mol。即制取1mol乙炔还需消耗(179+464) kJ热量,且反应③放出的热量不能完全利用,不合算。 三个反应的熵变均大于零。反应(1)和(2)是吸热反应,因此高温有利于反应。反应(3)是放热反应,因此常温有利于反应。
【解析】
(1)根据盖斯定律,制取1mol C2H2(g)需3 mol C(s)(36g),反应C(g)+O2(g)=CO2(g)
ΔH=-393 kJ/mol,故3mol C完全反应放出3×393=1179kJ的能量;
(2)虽然燃烧1mol C2H2(g)放热多于燃烧3 mol C(s)。但反应△rH(298K,①)=+179kJ/mol,△rH(298K,②)=+464kJ/mol,△rH(298K,③)=-63kJ/mol。即制取1mol乙炔还需消耗(179+464)KJ热量,且反应③放出的热量不能完全利用,不合算。
(3)三个反应的熵变均大于零。反应(1)和(2)是吸热反应,因此高温有利于反应。反应(3)是放热反应,因此常温有利于反应。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g) ![]() H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早使用的金属,被广泛应用于电气、轻工、机械制造和国防工业等.已知![]() 与
与![]() 能发生反应:
能发生反应:![]()
(1)为确定某温度下![]() 固体的分解产物.称取
固体的分解产物.称取![]() 样品,将该样品在坩埚中加热完全分解,冷却至室温后,测得剩余固体质量为
样品,将该样品在坩埚中加热完全分解,冷却至室温后,测得剩余固体质量为![]() ,该固体的成分为 ______ ,若将所得固体溶于足量稀硫酸,所得固体质量为 ______
,该固体的成分为 ______ ,若将所得固体溶于足量稀硫酸,所得固体质量为 ______ ![]()
(2)科学研究发现![]() 可作为太阳光分解水的催化剂.
可作为太阳光分解水的催化剂.
Ⅰ通过以下四种方法来制备![]()
![]() 火法还原:用炭粉在高温条件下还原CuO;
火法还原:用炭粉在高温条件下还原CuO;
![]() 用
用![]() 还原新制电解的
还原新制电解的![]() ;
;
![]() 电解法:
电解法:![]()
![]()
![]() ;
;
![]() 最新实验研究用肼
最新实验研究用肼![]() 还原新制
还原新制![]() 可制备纳米级
可制备纳米级![]() ,同时放出
,同时放出![]() .
.
![]() 该制法的化学方程式为 ______ .
该制法的化学方程式为 ______ .
![]() 肼性质与氨气相似,易溶于水,可发生如下两步电离过程:
肼性质与氨气相似,易溶于水,可发生如下两步电离过程:
![]() /span>I
/span>I
![]() II
II
常温下,某浓度![]() 溶液的pH为4,则该溶液中由水电离产生的
溶液的pH为4,则该溶液中由水电离产生的![]() 为 ______ .
为 ______ .
已知在相同条件下过程I的进行程度大于![]() 的水解程度.常温下,若
的水解程度.常温下,若![]()
![]() 溶液与
溶液与![]() HCl溶液等体积混合,则溶液中
HCl溶液等体积混合,则溶液中![]() 、
、![]() 、
、![]() 、
、![]() 离子浓度由大到小的顺序为 ______ .
离子浓度由大到小的顺序为 ______ .
Ⅱ用制得的![]() 进行催化分解水的实验.
进行催化分解水的实验.
用以上四种方法制得的![]() 在相同条件下分别对水进行催化分解,产生氢气的体积
在相同条件下分别对水进行催化分解,产生氢气的体积![]() 随时间t变化如图所示,则下列说法正确的是 ______ .
随时间t变化如图所示,则下列说法正确的是 ______ .
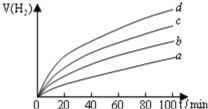
A.c、d方法制得的![]() 催化效率相对较高
催化效率相对较高
B.d方法制得的![]() 作催化剂时,水的平衡转化率最高
作催化剂时,水的平衡转化率最高
C.催化效果与![]() 颗粒的粗细、表面活性等有关
颗粒的粗细、表面活性等有关
D.分解等物质的量的水时,d方法制得的![]() 作催化剂所需吸收的能量最低.
作催化剂所需吸收的能量最低.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 微溶于水,可溶于硝酸。溶液X中可能含有
微溶于水,可溶于硝酸。溶液X中可能含有![]() 中的几种离子。为了确定其组成,某同学进行了如下实验:
中的几种离子。为了确定其组成,某同学进行了如下实验:
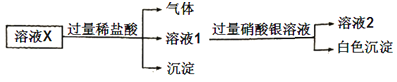
下列说法正确的是( )
A.溶液X中一定含有![]()
![]() 和
和![]()
B.溶液X中一定不含![]() 、
、![]()
C.为确定溶液X中是否含有![]() ,可取溶液2,加入
,可取溶液2,加入![]() 溶液
溶液
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将pH均为a的NaOH溶液和氨水分别加水稀释100倍,pH分别变为b和c,则a、b、c的大小关系为b>c>a
B. 常温下0.1 molL-1 KHA溶液的pH=3,则该溶液中C(A2- )<c(H2A)
C. 室温时 M(OH)2(s)![]() M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +
M2+(aq)+2OH-(aq) Ksp=a,则当 c(M2+)=b molL-1 时,溶液的pH为14 +![]() 1g
1g![]()
D. 0.1 molL-1 Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
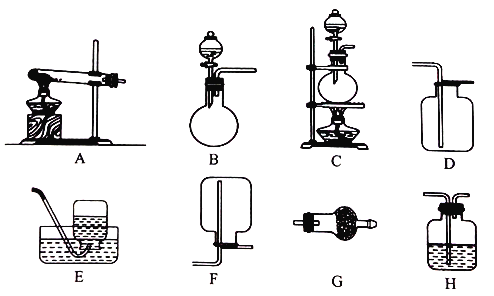
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,向10mL0.10mol·L-1的一元弱酸HA(Ka =1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )

A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A- )+c(OH-)
D.V =10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中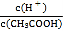 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中![]() 不变
不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com