
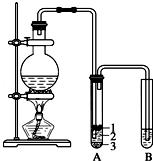
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:分析 (1)根据反应原理判断需要的反应物;根据仪器的使用方法和实验的目的来选择所需仪器;
(2)根据物质的性质进行书写反应的化学方程式;
(3)根据实验仪器的特点和有机物的性质来分析;
(4)根据HBr和CH3CH2OH都易挥发来分析;
(5)根据反应过程中生成的单质溴具有强氧化性进行分析;
(6)反应中有溴单质生成,溴单质具有强氧化性,能够腐蚀橡胶.
解答 解:(1)乙醇与溴化氢反应制取溴乙烷,则反应物中还缺少乙醇;此实验量取溶液的体积要求精确度不是很高,可用量筒量取,
故答案为:乙醇;b;
(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,反应的化学方程式为:NaBr+H2SO4═HBr+NaHSO4、CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O,
故答案为:CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O;
(3)反应生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,
故答案为:3;
(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,
故答案为:HBr或CH3CH2OH;
(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离;在加热温度较高时,乙醇发生消去反应生成乙烯,乙烯能够使酸性高锰酸钾溶液褪色,
故答案为:d; 乙烯;
(6)浓硫酸具有强氧化性,将HBr氧化物Br2,生成的Br2具有强氧化性,会腐蚀橡胶,应用玻璃导管,
故答案为:反应会产生Br2,腐蚀橡胶.
点评 本题主要考查溴乙烷的制备、提纯、有机反应等复杂性以及实验安全等知识,题目难度中等,掌握相关物质的基本化学性质熟悉该装置和反应原理是解答本题的关键,平时须注意积累相关反应知识.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
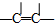 | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中和时所需NaOH的量 | B. | 电离的程度 | ||
| C. | H+的物质的量浓度 | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| N | O | F |
| P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
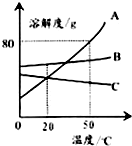
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去N2中的少量O2,可通过灼热的Cu网后,收集气体 | |
| B. | 除去FeCl3溶液中Fe(OH)3沉淀可以过滤 | |
| C. | 除去乙醇中的少量NaCl,可用蒸馏的方法 | |
| D. | 重结晶不能用于提纯物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16:9 | B. | 23:9 | C. | 1:2 | D. | 2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com