
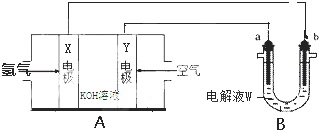
·ÖĪö £Ø1£©×°ÖĆAĪŖĒāĘųČ¼ĮĻµē³Ų£¬Č¼ĮĻŌŚøŗ¼«·¢ÉśŃõ»Æ·“Ó¦£¬Éś³ÉĖ®£¬µ¼ÖĀČÜŅŗpH¼õŠ”£¬ŃõĘųŌŚÕż¼«·¢Éś»¹Ō·“Ó¦£¬Éś³ÉĒāŃõøłĄė×Ó£»
£Ø2£©øł¾ŻĶ¼ÖŖ£¬YŹĒÕż¼«£¬aŹĒŃō¼«£¬bĪŖĢśµē¼«ŹĒŅõ¼«£¬µē½ā±„ŗĶŹ³ŃĪĖ®Ź±£¬Ņõ¼«ÉĻĒāĄė×ӷŵēÉś³ÉĒāĘų£¬Ķ¬Ź±Éś³ÉĮĖĒāŃõøłĄė×Ó£¬ČÜŅŗµĪÓŠ·ÓĢŖµÄČÜŅŗĻŌŹ¾ŗģÉ«£»æÉŅŌĶØČėŹŹĮæHClĄ“»Öø“ŌČÜŅŗµÄ³É·ÖŗĶÅØ¶Č£»
£Ø3£©ĶµÄµē½ā¾«Į¶ÖŠ£¬“ÖĶ½ÓŃō¼«£¬ŅņĪŖŃō¼«ÉĻÓŠ±ČĶ»īĘĆµÄ½šŹō·Åµē£¬µ¼ÖĀĶĄė×ÓÅØ¶Č¼õŠ”£»
£Ø4£©×°ÖĆĪŖµē¶Ę×°ÖĆ£¬Ķ°ōŌöÖŲ2.16g£¬ĪŖAgµÄÖŹĮ棬¾Ż“Ė¼ĘĖćµē×Ó×ŖŅĘ£®
½ā“š ½ā£ŗ£Ø1£©×°ÖĆAÖŠµÄYµē¼«ĪŖÕż¼«£¬Xµē¼«µÄµē¼«·“Ó¦Ź½ĪŖH2-2e-+2OH-=2H2O£¬ĒāŃõøłĄė×ÓµÄÅØ¶Č¼õŠ”£¬ĖłŅŌPH½«¼õŠ”£¬¹Ź“š°øĪŖ£ŗÕż¼«£»H2-2e-+2OH-=2H2O£»¼õŠ”£»
£Ø2£©øł¾ŻĶ¼ÖŖ£¬YŹĒÕż¼«£¬aŹĒŃō¼«£¬bĪŖĢśµē¼«ŹĒŅõ¼«£¬µē½ā±„ŗĶŹ³ŃĪĖ®Ź±£¬Ņõ¼«ÉĻĒāĄė×ӷŵēÉś³ÉĒāĘų£¬Ķ¬Ź±Éś³ÉĮĖĒāŃõøłĄė×Ó£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ2H++2e-=H2”ü£»ČÜŅŗµĪÓŠ·ÓĢŖµÄČÜŅŗĻŌŹ¾ŗģÉ«£»æÉŅŌĶØČėŹŹĮæHClĄ“»Öø“ŌČÜŅŗµÄ³É·ÖŗĶÅØ¶Č£¬¹Ź“š°øĪŖ£ŗ2H++2e-=H2”ü£¬ĶØČėŹŹĮæHCl£»
£Ø3£©µē¶Ę·Ø¾«Į¶ĶŹ±£¬“ÖĶĪŖŃō¼«£¬¾«ĶĪŖŅõ¼«£¬ĖłŅŌŃō¼«²ÄĮĻŹĒ“ÖĶ£»Ńō¼«ÉĻŹ§µē×Ó±ä³ÉĄė×Ó½ųČėČÜŅŗ£¬Ņņ×÷Ńō¼«µÄ“ÖĶÖŠµÄĶŗĶ±ČĶ»īĘĆµÄ½šŹō¶¼Ź§Č„µē×Ó½ųČėČÜŅŗ£¬Ņõ¼«ČÜŅŗÖŠCu2+µĆµ½µē×Ó³Į»żŌŚŅõ¼«ÉĻ£¬ĖłŅŌ£¬ĪŖŃō¼«aµē¼«Į¬½Ó“ÖĶ£¬µē½āŅ»¶ĪŹ±¼äŗó£¬ČÜŅŗÖŠĶĄė×ÓÅضČŌŚ¼õŠ”£¬
¹Ź“š°øĪŖ£ŗ“ÖĶ£»¼õŠ”£»
£Ø4£©Éś³Én£ØAg£©=$\frac{2.16g}{108g/mol}$=0.02mol£¬×ŖŅʵē×Ó0.02mol£¬¹Ź“š°øĪŖ£ŗ0.02mol£®
µćĘĄ ±¾Ģāæ¼²éĮĖČ¼ĮĻµē³ŲŗĶµē½ā³ŲµÄĻą¹ŲÖŖŹ¶£¬×ŖŅʵē×ÓŹŲŗćµÄÓ¦ÓĆ£¬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÖŹĮæ£ŗ¢Ś£¾¢Ł£¾¢Ū | B£® | ĒāŌ×ÓŹż£ŗ¢Ś£¾¢Ł£¾¢Ū | C£® | Ģå»ż£ŗ¢Ś£¾¢Ł£¾¢Ū | D£® | ĆÜ¶Č£ŗ¢Ś£¾¢Ū£¾¢Ł |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ū¢Ü | B£® | ¢Ł¢Ū¢Ü | C£® | ¢Ū | D£® | Č«²æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆNa”¢Mg·Ö±šÓėĄäĖ®·“Ó¦µÄŹµŃ饓֤Ć÷Na”¢MgµÄ½šŹōŠŌĒæČõ | |
| B£® | ÓĆMgCl2ŗĶAlCl3·Ö±šÓė¹żĮæ°±Ė®·“Ó¦µÄŹµŃéÖ¤Ć÷Mg”¢AlµÄ½šŹōŠŌĒæČõ | |
| C£® | ÓĆMgCl2ŗĶAlCl3·Ö±šÓė¹żĮæNaOHČÜŅŗÖš²½·“Ó¦µÄŹµŃéÖ¤Ć÷Mg”¢AlµÄ½šŹōŠŌĒæČõ | |
| D£® | ÓĆMg£ØOH£©2ŗĶAl£ØOH£©3·Ö±šÓėĒæ¼ī·“Ó¦µÄŹµŃ饓֤Ć÷Mg”¢AlµÄ½šŹōŠŌĒæČõ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
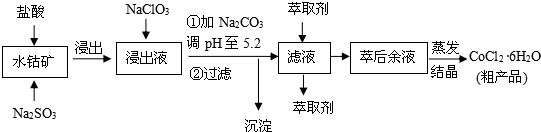
| ³ĮµķĪļ | Fe£ØOH£©3 | Fe£ØOH£©2 | Co£ØOH£©2 | Al£ØOH£©3 | Mn£ØOH£©2 |
| æŖŹ¼³Įµķ | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ĶźČ«³Įµķ | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com