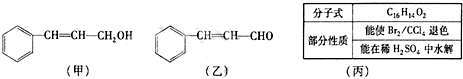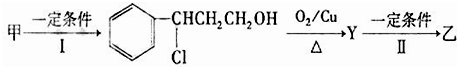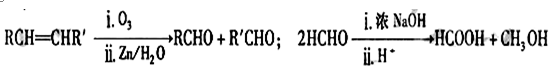������Ѫ�쵰����Ҫ��ɳɷ֣�������������֯����O
2�����ã���ȱ���Ϳ��ܳ���ȱ����ƶѪ��������һ�ֳ�������ҩƷ˵�����еIJ������ݣ���ҩƷ��Fe
2+ 33%-36%��������ˮ�������������е�θ���Vc��ά����C��ͬ�������ӱ�Ʒ���գ�
��ͬѧ���������ʵ����ò���ҩƷ���Ƿ���Fe
2+��̽��Vc�����ã�
ҩƬ
��Һ
����ɫ��Һ
Ѫ��ɫ��Һ
��Һ��ɫ
��1������������ˮ����Һ�з��������ӷ�Ӧ����ʽ��
��
��
��2������KSCN����Һ�䵭��ɫ��˵����Һ��������Fe
3+�������Ӵ��ڵĿ���ԭ��
��
A��ҩƷ�е���������Ӧ��������������ʽ����
B����ʵ�������������������������
C��ҩƷ�������������������������
��3����Ѫ��ɫ��Һ�м���һƬVcƬ��Ƭ�̺���ҺѪ��ɫ��ȥ��˵��Vc��
�ԣ�
����ͬѧ�������Ը�����ر�Һ�ζ����ⶨ��ҩƷ�Ƿ�ϸ�ԭ����5Fe
2++8H
++MnO
4-=5Fe
3++2Mn
2++4H
2O��ȷ��������ҩƷ10.00g������ȫ�������Լ�2�����1000mL��Һ��ȡ��20.00mL����0.0200mol?L
-1��KMnO
4 ��Һ�ζ�����ȥKMnO
4��Һ12.00mL��
��4����ʵ���е��Լ�2���ͬѧ���ʵ���е��Լ�1��������
�����ţ���
A������ˮ B��ϡ���� C��ϡ���� D��ϡ����
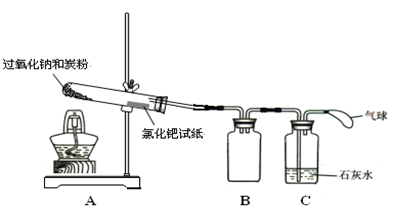
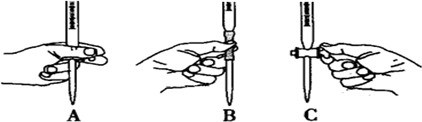
��5����ʵ��ζ������в����ζ��ܵ�ͼʾ��ȷ����
�����ţ���
��6���ж�ʵ�鵽��ζ��յ������Ϊ
��
��7���������ҩƷ����Ԫ�صİٷֺ���Ϊ
��



 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
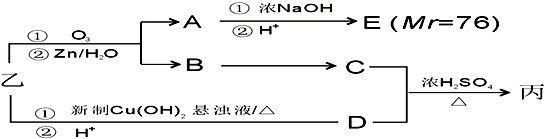
 ������A�����ϣ��������������֪����Է�������Ϊ136������ʽΪC8H8O2��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź���������ͼ������A������˵���У���ȷ���ǣ�˫ѡ����������
������A�����ϣ��������������֪����Է�������Ϊ136������ʽΪC8H8O2��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź���������ͼ������A������˵���У���ȷ���ǣ�˫ѡ����������