
【题目】如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
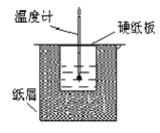
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
(6)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热数值____________(填“偏大”、“偏小”或“不变”)。
(7)量取溶液时,仰视读数。测得的中和热数值________(填“偏大”、“偏小”或“无影响”)
(8)实验过程中有液体洒在外面,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(9)混合酸、碱溶液时,动作缓慢,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(10)实验中能否用环形铁(铜)丝搅拌棒代替环形玻璃搅拌棒,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
【答案】环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 偏小 偏大 偏小 偏小 偏小 偏小
【解析】
(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
(3)若大烧杯上不盖硬纸板,会导致热量损失;
(4)改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热;
(5)一水合氨为弱碱,氨水的电离是一个吸热过程;
(6)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小;
(7)量取溶液的体积时仰视读数,会导致所量的氢氧化钠溶液和盐酸溶液体积偏大;
(8)实验过程中有液体洒在外面,会导致参与反应的反应物的物质的量减小;
(9)混合酸、碱溶液时,动作缓慢,会导致热量损失;
(10)环形铁(铜)丝导热,会导致热量损失。
(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差,所以还缺少环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)若大烧杯上不盖硬纸板,会导致热量损失,使求得的反应热数值偏小,故答案为:偏小;
(4)中和热是在一定条件下,稀溶液中酸和碱反应生成1mol水时放出的热量,改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热,故答案为:不变;
(5)一水合氨为弱碱,氨水的电离是一个吸热过程,吸热导致测得的中和热数值会偏小,故答案为:偏小;
(6)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小,测得的中和热数值偏小,故答案为:偏小;
(7)量取溶液的体积时仰视读数,会导致所量的氢氧化钠溶液和盐酸溶液体积偏大,参与反应的反应物偏多,放出的热量偏大,故答案为:偏大;
(8)实验过程中有液体洒在外面,会导致参与反应的反应物的物质的量减小,使测得的中和热数值会偏小,故答案为:偏小;
(9)混合酸、碱溶液时,动作缓慢,会导致热量损失,使测得的中和热数值会偏小,故答案为:偏小;
(10)实验中能否用环形铁(铜)丝搅拌棒代替环形玻璃搅拌棒,环形铁(铜)丝导热,会导致热量损失,使测得的中和热数值会偏小,故答案为:偏小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】分析下面的能量变化示意图,下列热化学方程式正确的是
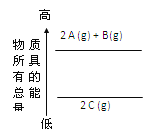
A. 2A(g)+ B(g)=2C(g)△H=a(a>0)B. 2A(g)+ B(g)=2C(g)△H=a(a<0)
C. 2A + B=2 C△H=a(a<0)D. 2C=2A +B△H=a(a>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,不是氧化还原反应的是( )
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2+H2O=HClO+HClD.CuCl2+Ba(OH)2=Cu(OH)2+BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是 ()
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列关系表示正确的是 ()
A. 5v(NH3)=6v(O2)B. 5v(O2)=6v(H2O)
C. 2v(NH3)=2v(H2O)D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁元素是构成人体的必不可少的元素之一,缺铁会影响到人体的健康和发育,最大的影响是缺铁性贫血。此类病人需要服用补铁药品。

一个体重50 kg的健康人含铁2 g,这2g铁在人体中以Fe2+和Fe3+的形式存在。以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是________。
A.Fe B.Fe2+ C.Fe3+
(2)亚硝酸钠有毒,有传言说亚硝酸钠是致癌物质,但事实上亚硝酸钠并不是致癌物质,致癌的是亚硝酸钠在一定条件下生成的亚硝胺。工业盐的主要成分是NaNO2,曾多次发生过因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有_______性。下列不能实现上述转化的物质是_______。
A.Cl2 B.O2 C.FeCl3 D.KMnO4(H+)
(3)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了________性和________性,则生成1分子NO转移电子数为________;56g Fe参加反应时,被还原的HNO3为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是
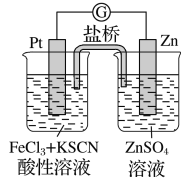
A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2的转化再利用能够很好的减少温室效应,给环境问题的解决提供了一个很好的方法。其中用有机合成的方式可以合成醋酸、甲醇等,用无机方式转化为碳酸盐或者碳酸氢盐。
I.(1)土壤中也含有碳酸盐,土壤中Na2CO3含量较高时,pH可高达10.5,试用离子方程式解释土壤呈碱性的原因:_______________。加入石膏(CaSO4·5H2O)可以使土壤碱性降低,原因是(用化学用语表达)_____________________________。
(2)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/LHCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。回答下列问题:
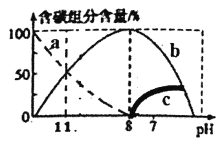
①在同一溶液中,H2CO3、HCO3-、CO32-_____(填“能”或“不能”)大量共存。
②溶液中各种粒子的物质的量浓度关系正确的是为_______。
A.pH=11时:c(Na+)>c(H2CO3)>c(CO32-)>c(OH-)>c(H+)
B.pH=11时:c(HCO3-)>c(Cl-)
C.pH=7时: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)=c(H+)
D.pH=11时: c(Na+)+c(H+)=3c(CO32-)+c(OH-)
③计算出碳酸钠的水解平衡常数为________。
II.醋酸成本低,在生产中被广泛应用。
(1)若某温度下,CH3COOH(aq)与NaOH(aq)反应的△H=-46.8kJ/mol,则H2SO4(aq)与NaOH(aq)的中和热为57.3kJ/mol,则CH3COOH在水溶液中电离的△H=_________。
(2)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势.其合成的基本反应如下: CH2=CH2(g)+CH3COOH(l) ![]() CH3COOC2H5(l) 该反应类型是______,为提高乙酸乙酯的合成速率和产率,可以采取的措施有________(任写出一条)。
CH3COOC2H5(l) 该反应类型是______,为提高乙酸乙酯的合成速率和产率,可以采取的措施有________(任写出一条)。
(3)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在保持不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。
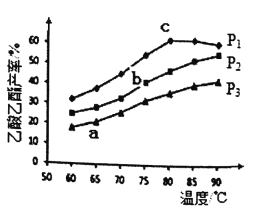
回答下列问题:
①温度在60~80℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是______[用v(P1).v(P2)、v(P3)分别表示不同压强下的反应速率];
②a、b、c三点乙烯的转化率从大到小顺序______。
③P1下乙酸乙酯的产率60℃~90℃时,先升高后降低的原因是_______,根据测定实验结果分析,较适宜的生产条件是___________(合适的压强和温度)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生命科学常用图示表示微观物质的结构,图中甲、乙、丙分别表示植物细胞中常见的三种有机物,则甲、乙、丙可分别表示( )

A.DNA、蛋白质、糖原B.蛋白质、核酸、蔗糖
C.多肽、RNA、淀粉D.DNA、RNA、纤维素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com