
分析 根据价电子对互斥理论确定微粒的空间构型和原子的杂化方式,价层电子对个数=σ键个数+孤电子对个数.σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据等电子体是指具有相同电子数目和原子数目的分子或离子来回答与NH4+互为等电子体的分子.
解答 解:SO32-离子中S原子孤电子对数=$\frac{6+2-2×3}{2}$=1,价层电子对数=3+1=4,形成4条新的杂化轨道,采用了sp3杂化,含有一对孤对电子,占据一条杂化轨道,对S-O键有排斥作用,S与O构成三角锥型,NH4+离子中价层电子对=4+$\frac{5-4-1}{2}$=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体,该离子中含有不孤电子对,所以其空间构型为正四面体,NH4+中电子数为:7+4-1=10,原子数为5,CH4中电子数为:6+4=10,原子数为5,和NH4+是等电子体,
故答案为:三角锥型;sp3;正四面体;CH4.
点评 本题考查微粒空间构型判断、价层电子对互斥理论、等电子体等,侧重考查学生对知识的理解与迁移应用,注意杂化理论的熟练应用,为高频考点,题目难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:解答题
 ).
).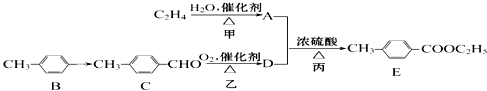
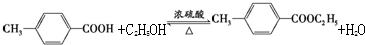 .
. (其中一种).(只答其中一种即可)ⅰ含有苯环;ⅱ能够发生银镜反应.
(其中一种).(只答其中一种即可)ⅰ含有苯环;ⅱ能够发生银镜反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
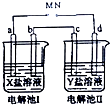 下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.
下图所示的电解池Ⅰ和Ⅱ溶液体积均为100mL,a、b和d均为Pt电极.电解过程中,电极b和d质量均增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )
黄曲霉素AFTB1(如图)是污染粮食的真菌霉素.人类的特殊基因在黄曲霉素的作用下会发生突变,有转变成肝癌的可能性.与1mol黄曲霉素起反应的H2或NaOH的最大量分别是( )| A. | 6mol,2mol | B. | 7mol,2mol | C. | 6mol,1mol | D. | 7mol,1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠的电子式: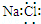 | |
| B. | 聚乙烯的结构简式: | |
| C. | 硫离子的结构示意图: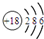 | |
| D. | 碳酸氢铵的电离方程式:NH4HCO3=NH4++H++CO32ˉ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度和体积一定时,容器内压强不再变化 | |
| B. | 生成H2和生成HI的速率相等 | |
| C. | 混合气体的颜色不再变化 | |
| D. | 各物质的物质的量浓度之比为2:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com