
已知在0.1 mol·L-1的NaHSO3溶液中有关微粒浓度由大到小的顺序为[Na+]>[HSO ]>[SO
]>[SO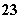 ]>[H2SO3]。
]>[H2SO3]。
(1)该溶液中[H+]________[OH-](填“>”、“<”或“=”),简述理由:
________________________________________________________________________
________________________________________________________________________。
(2)现向NH4HSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是________________________________________________________________________
________________________________________________________________________;
写出该反应的离子方程式
________________________________________________________________________
________________________________________________________________________。
科目:高中化学 来源: 题型:
写出用惰性电极电解下列电解质溶液的电极反应式及电解反应的化学方程式
(1)Ba(OH)2:____________________________________________________________;
(2)Na2CO3: __________________________________________________________;
(3)KCl: ____________________________________________________________;
(4)AgNO3: ___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol·L-1的二元酸H2A溶液的pH=4,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有[Na+]+[H+]=[HA-]+[OH-]+2[A2-]
D.在Na2A溶液中一定有[Na+]>[A2-]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
在0.1 mol·L-1的NaHCO3溶液中,下列关系正确的是( )
A.[Na+]>[HCO ]>[H+]>[OH-]
]>[H+]>[OH-]
B.[Na+]=[HCO ]>[OH-]>[H+]
]>[OH-]>[H+]
C.[Na+]+[H+]=[HCO ]+[OH-]+2[CO
]+[OH-]+2[CO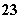 ]
]
D.[Na+]+[H+]=[HCO ]+[OH-]+[CO
]+[OH-]+[CO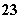 ]
]
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应: _________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
①NaCl溶液的浓度是________mol·L-1。
②Ⅳ中检测Cl2的实验方法_________________。
③与Ⅱ对比,得出的结论(写出两点): _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关电解质溶液中微粒的物质的量浓度关系正确的是双选) )。
A.在0.1 mol·L-1 NaHCO3溶液中:cNa+)>cHCO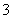 )>cCO
)>cCO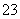 )>cH2CO3)
)>cH2CO3)
B.在0.1 mol·L-1 Na2CO3溶液中:cOH-)-cH+)=cHCO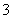 )+2cH2CO3)
)+2cH2CO3)
C.向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:cCO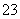 )>cHCO
)>cHCO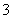 )>cOH-)>cH+)
)>cOH-)>cH+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,cNa+)=0.1mol·L-1]:cNa+)
=cCH3COO-)>cCH3COOH)>cH+)=cOH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,体积为2 L的密闭容器中A、B、C三种气体的起始浓度和平衡浓度如下表:
| 物质 | A | B | C |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法中正确的是( )
A.发生的反应可表示为A+B2C
B.反应达到平衡时B的转化率为25%
C.若起始时密闭容器中有0.1 mol A、0.1 mol B、0.2 mol C时,反应达平衡时,c(A)=0.05 mol·L-1
D.改变起始时容器中各气体的物质的量,可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,正确的是( )
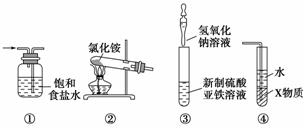
A.装置①是洗气装置,除去氯气中的氯化氢
B.实验室用装置②制取氨气
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④中X若为四氯化碳,可用于吸收氨气,并防止倒吸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com